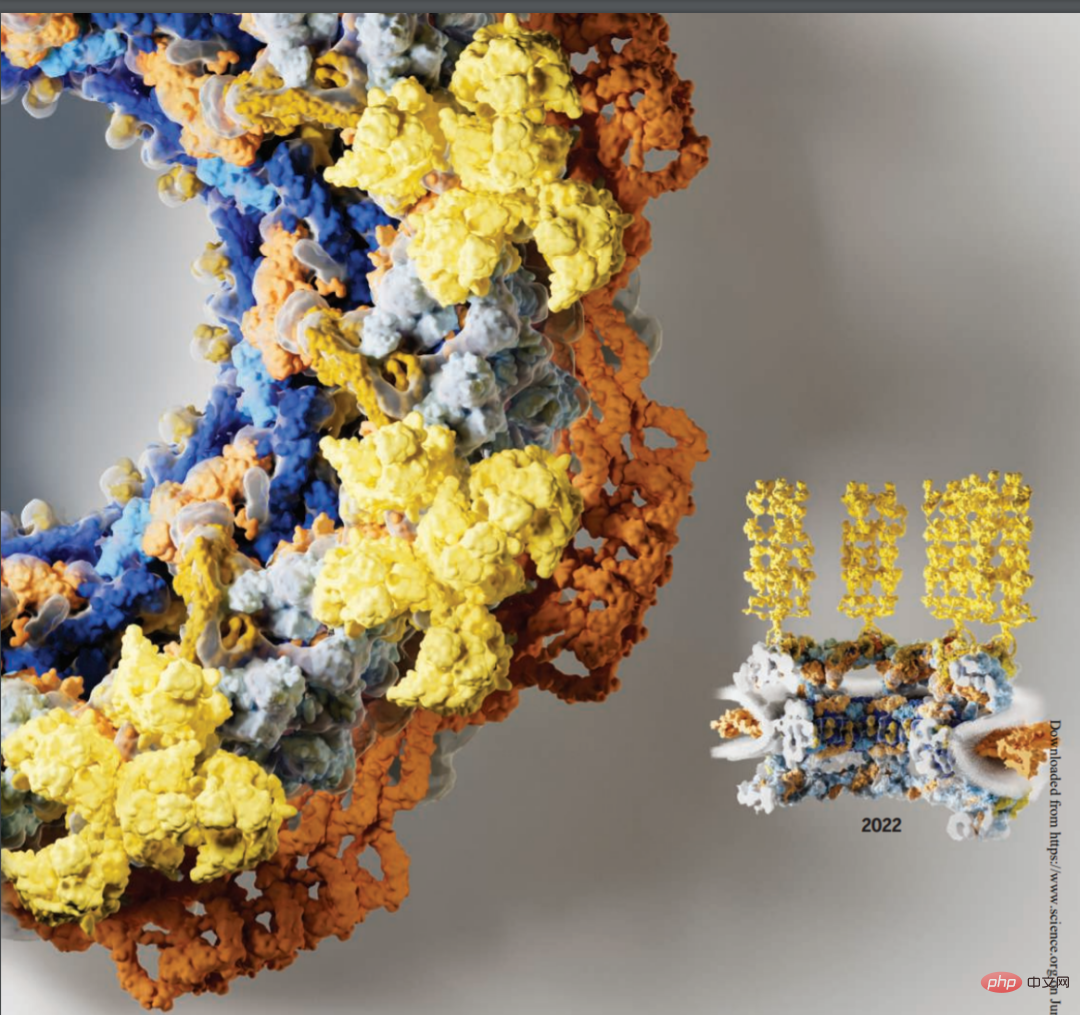
开始正文之前,我们先来看一张图片,在下图中,很明显可以看出,图的右半部分所代表的信息更加丰富,结构也更清晰。而左半部分 2016 年的图,则结构较为单一,代表的信息比较少:

其实上面展示的是核孔复合体(NPC)图像。核孔复合体,由约 1000 个蛋白质亚基组成,担负着真核生物细胞核与细胞质之间繁忙的运输大分子的任务,也是其连接胞质和细胞核的唯一双向通道。除了协调运输外,NPC 还组织必要的转录、mRNA 成熟、剪接体和核糖体组装等重要生命活动。NPC 强大的作用,已然成为疾病突变和宿主 - 病原体相互作用的关键点。
得益于低分辨率下全核孔结构以及高分辨率下核孔组成结构技术的发展,细胞核孔受到越来越多的关注。然而,利用这些信息正确组装 30 多种不同蛋白质副本,并构建高分辨率的三维结构,一直是一项艰巨的挑战。
今天,《Science》杂志以封面专题形式发表了 5 篇论文,其中 3 篇论文共同揭开了人类核孔复合体的近原子分辨率冷冻电镜结构,另外两项研究通过非洲爪蟾呈现了脊椎动物核孔复合体的单颗粒冷冻电镜图像。这篇封面文章将多项研究成果拼接在一起,形成的人类 NPC 图像接近原子级。

论文地址:https://www.science.org/doi/pdf/10.1126/science.add2210
这一研究成果建立在多项研究之上,包括数十年的生物化学重建、X 射线晶体学、质谱学、诱变和细胞生物学等。使用大幅度改进的冷冻电子断层扫描重建人类 NPC,并用人工智能技术精确建模组件。还有其他研究提高了单粒子冷冻电镜的分辨率,使脊椎动物 NPC 的二级结构元素和残基水平细节的可视化成为可能。分子组合丰富了我们对脊椎动物和人类 NPC 构建的理解——从旧的核支架到将各个部分连接在一起的连接蛋白,以及从核膜锚定到中央运输通道上方的细胞质丝。
这里报告的研究成果,代表了实验结构生物学与人工智能的合作共赢,是人类探索生物微观世界的又一次胜利。另外,也证明了正在进行的分辨率革命,在我们寻求了解大分子组件的构造和设计原理方面,具有不可替代地作用。
下图为 2022 年人类核孔复合体的横截面视图,新解析的成分包括对称核心(橙色)和细胞质细丝(黄色):
五篇研究论文
论文 1:《Architecture of the cytoplasmic face of the nuclear pore》

论文地址:https://www.science.org/doi/10.1126/science.abm9129
核孔复合体(NPC)是核质转运的唯一双向通道。尽管最近在阐明 NPC 对称核心结构方面取得了一些进展,但对于 mRNA 输出和核孔蛋白相关疾病的热点来说,不对称分布的细胞质表面仍然难以捉摸。
加州理工学院等机构的研究者报告了通过结合生化重建、晶体结构测定、冷冻电子断层扫描重建和生理验证而获得的人类细胞质面的复合结构。虽然物种特异性基序在中央转运通道上方锚定了一个进化上保守、约 540 千道尔顿(kilodalton)异六聚体细胞质细丝核孔蛋白复合体,但 NUP358 五聚体束的附着取决于外套核孔蛋白复合体的双环排列。他们揭示的复合结构及其预测能力为阐明 mRNA 输出和核孔蛋白疾病的分子基提供了丰富的基础。
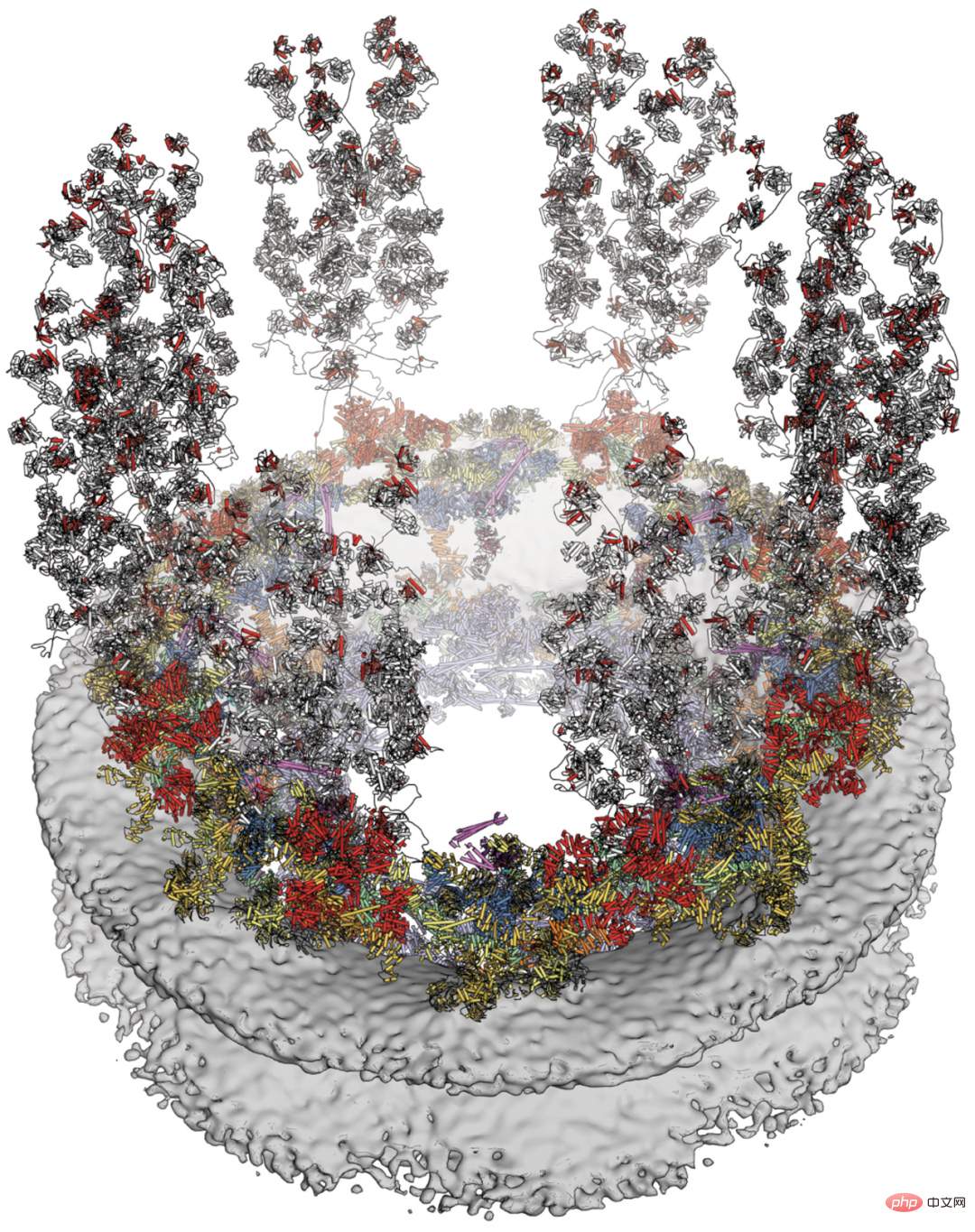
人类 NPC 的细胞质面。
论文 2:《Architecture of the linker-scaffold in the nuclear pore》

论文地址:https://www.science.org/doi/10.1126/science.abm9798
尽管人们已经可以确定 NPC 对称核心中结构化支架核孔蛋白的排列,但它们通过多价非结构化接头核孔蛋白的内聚性仍然难以捉摸。
通过结合生化重建、高分辨率结构测定、冷冻电子断层扫描重建和生理验证,加州理工学院的研究者阐明了进化上保守的接头支架结构,产生了人类 NPC 的约 64 兆道尔顿(megadalton)对称的近原子复合结构核。虽然接头通常起刚性作用,但 NPC 的接头支架为其中央转运通道的可逆收缩和扩张以及横向通道的出现提供了必要的可塑性和稳健性。他们的结果大大推进了 NPC 对称核心的结构表征,为未来的功能研究打下了基础。
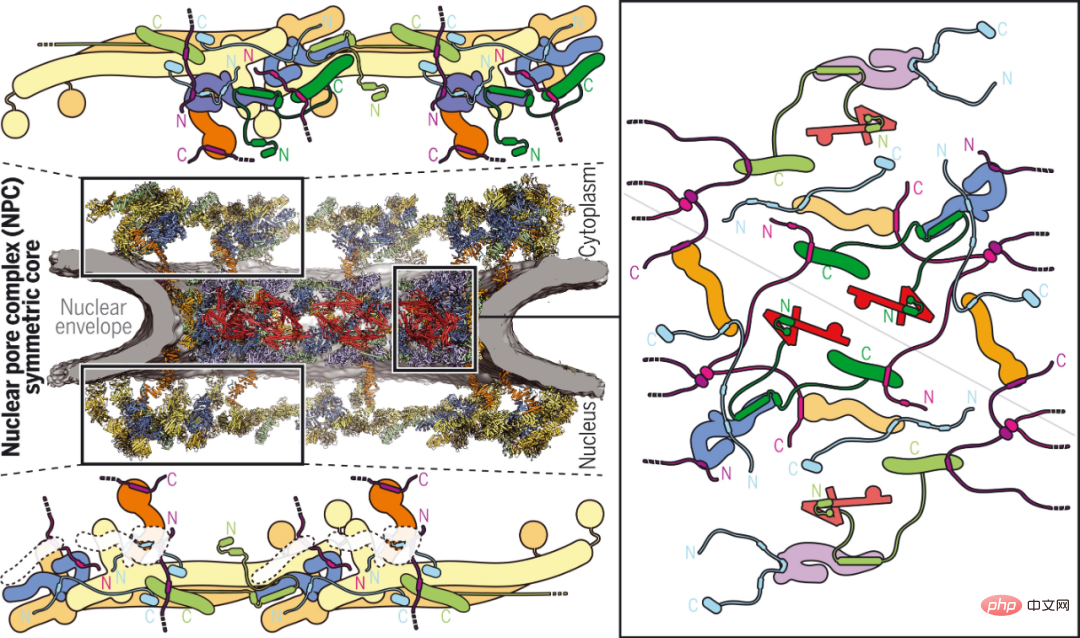
人类 NPC 对称核心的接头支架结构。
论文 3:《AI-based structure prediction empowers integrative structural analysis of human nuclear pores》

论文地址:https://www.science.org/doi/10.1126/science.abm9506
虽然核孔复合体(NPC)介导核质转运,它们错综复杂的 120 兆道尔顿架构仍未完全得到了解。马克斯 · 普朗克生物物理研究所等机构的研究者报告了具有显式膜和多构象状态的人类 NPC 支架的 70 兆道尔顿模型。
他们将基于 AI 的结构预测与原位和细胞冷冻电子断层扫描、综合建模相结合。结果表明,接头核孔蛋白在亚复合体内和亚复合体之间组织支架,以建立高阶结构。微秒长的分子动力学模拟表明,支架不需要稳定内外核膜融合,而是扩大中心孔。他们举例阐释了如何将基于 AI 的建模与原位结构生物学相结合,以了解跨空间组织级别的亚细胞结构。
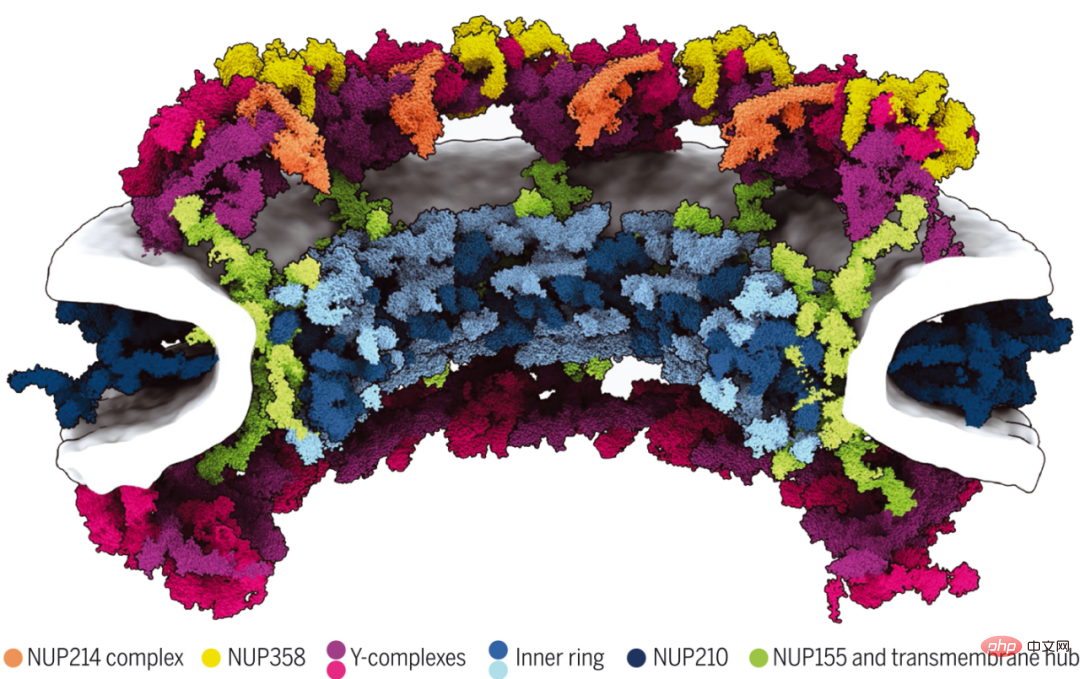
人类 NPC 支架架构的 70 兆道尔顿模型。
论文 4:《Structure of the cytoplasmic ring of the Xenopus laevis nuclear pore complex》

论文地址:https://www.science.org/doi/10.1126/science.abl8280
西湖大学和清华大学以 3.7-4.7 埃(angstrom)的分辨率对非洲爪蟾 NPC 的细胞质环亚基进行单粒子冷冻电子显微镜重建。其中,Nup358 的氨基末端域的结构被解析为 3.0 埃,这有助于识别每个细胞质环亚基中的五个 Nup358 分子。
研究者最终的细胞质环亚基模型包括五个 Nup358、两个 Nup205 和两个 Nup93 分子,以及两个先前表征的 Y 复合体。Nup160 的羧基末端片段充当每个 Y 复合体顶点的组织中心。结构分析揭示了 Nup93、Nup205 和 Nup358 如何促进和加强主要由两层 Y 复合体形成的细胞质环支架的组装。
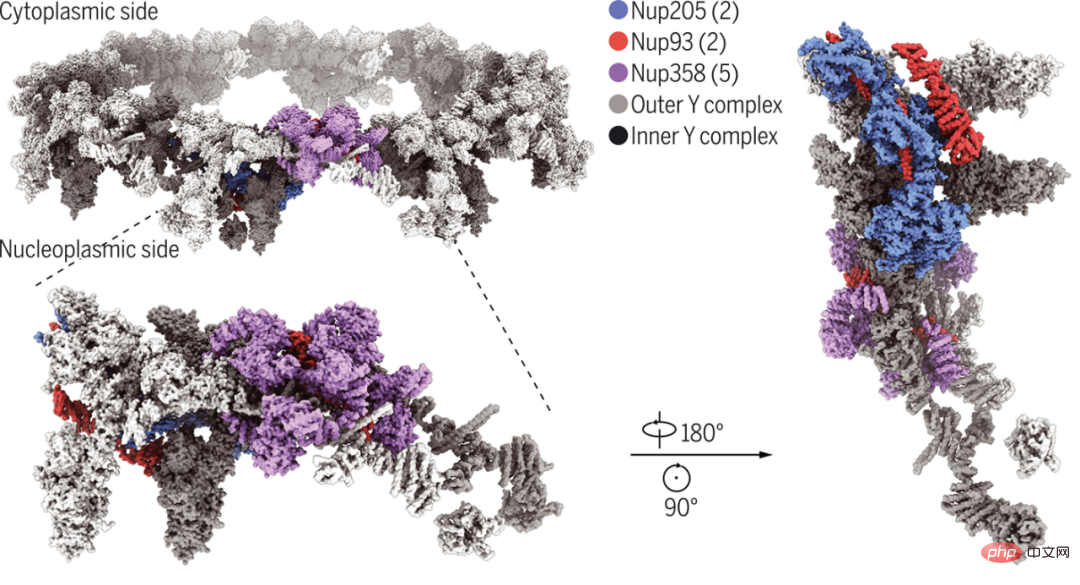
非洲爪蟾 NPC 双层细胞质环的 Cryo-EM 结构。
论文 5:《Structure of cytoplasmic ring of nuclear pore complex by integrative cryo-EM and AlphaFold》

论文地址:https://www.science.org/doi/10.1126/science.abm9326
哈佛医学院等机构的研究者使用单粒子冷冻电子显微镜和 AlphaFold 预测,从非洲爪蟾卵母细胞中确定了近乎完整的 NPC 细胞质环结构。具体地,他们使用 AlphaFold 预测核孔蛋白的结构,并使用突出的二级结构密度作为指导来适应中等分辨率的地图。
此外,某些分子相互作用通过使用 AlphaFold 的复杂预测进一步得到建立或确认。研究者确定了五份 Nup358 的结合模式,它是最大的 NPC 亚基,具有用于转运的 Phe-Gly 重复序列。他们预测 Nup358 包含一个卷曲螺旋结构域,可以提供活性以帮助它在一定条件下作为 NPC 形成的成核中心。
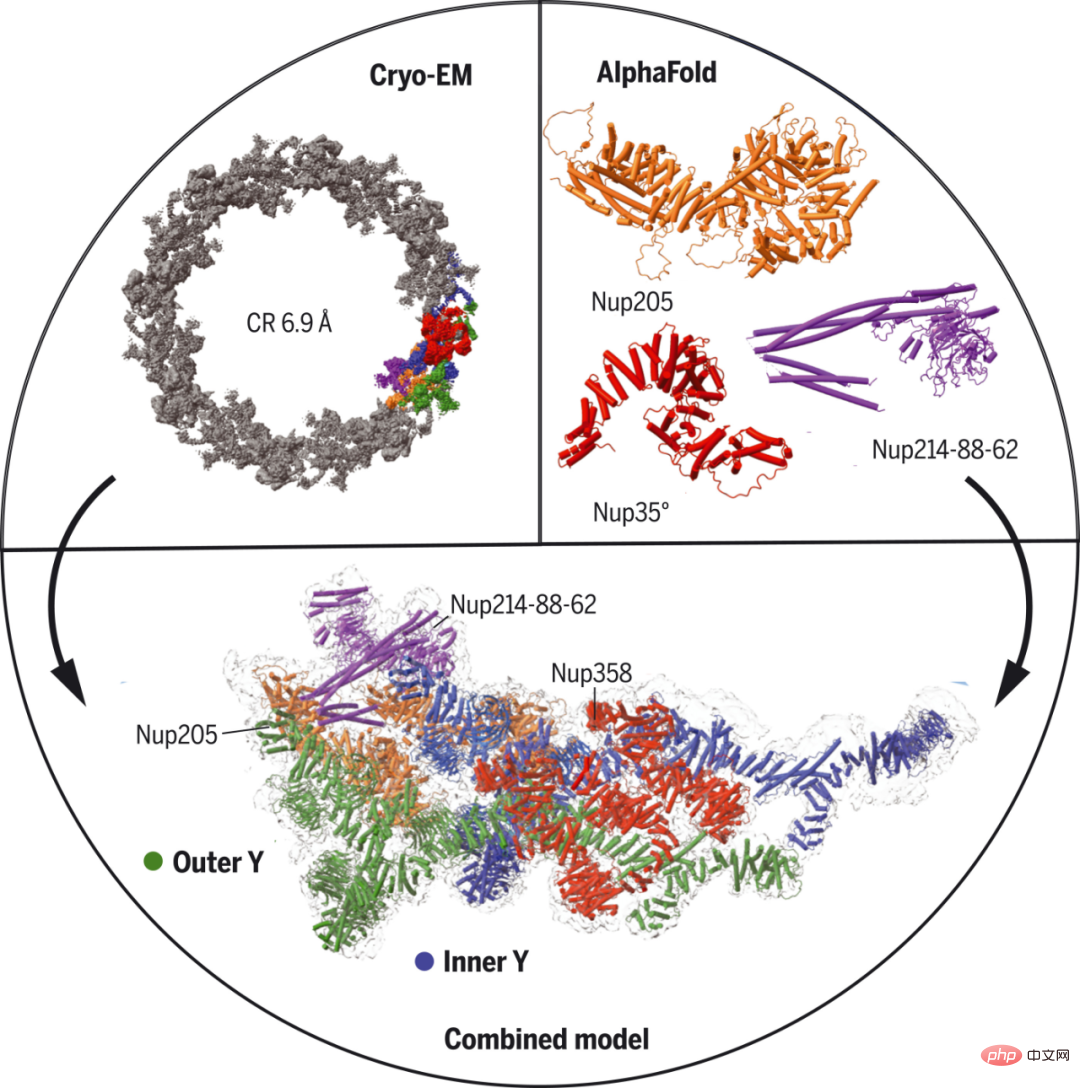
非洲爪蟾 NPC 细胞质环的 Cryo-EM 结构。
以上是施一公等团队登Science封面:AI与冷冻电镜揭示「原子级」NPC结构,生命科学突破的详细内容。更多信息请关注PHP中文网其他相关文章!
 用Ollama -Analytics Vidhya简化本地LLM部署Apr 19, 2025 am 11:01 AM
用Ollama -Analytics Vidhya简化本地LLM部署Apr 19, 2025 am 11:01 AM利用Ollama本地开源LLMS的力量:综合指南 运行大型语言模型(LLMS)本地提供无与伦比的控制和透明度,但是设置环境可能令人生畏。 Ollama简化了这个过程
 如何使用Monsterapi微调大语言模型Apr 19, 2025 am 10:49 AM
如何使用Monsterapi微调大语言模型Apr 19, 2025 am 10:49 AM利用微调LLM的功能与Monsterapi:综合指南 想象一个虚拟助手完美理解并预测您的需求。 由于大型语言模型(LLMS)的进步,这已成为现实。 但是,
 5统计测试每个数据科学家都应该知道-Analytics VidhyaApr 19, 2025 am 10:27 AM
5统计测试每个数据科学家都应该知道-Analytics VidhyaApr 19, 2025 am 10:27 AM数据科学的基本统计测试:综合指南 从数据中解锁有价值的见解至关重要。 掌握统计测试对于实现这一目标至关重要。这些测试使数据科学家能够严格瓦尔
 如何使用Florence -2 -Analytics Vidhya执行计算机视觉任务Apr 19, 2025 am 10:21 AM
如何使用Florence -2 -Analytics Vidhya执行计算机视觉任务Apr 19, 2025 am 10:21 AM介绍 原始变压器的引入为当前的大语言模型铺平了道路。同样,在引入变压器模型之后,引入了视觉变压器(VIT)。喜欢
 使用Langchain Text Splitters -Analytics Vidhya拆分数据的7种方法Apr 19, 2025 am 10:11 AM
使用Langchain Text Splitters -Analytics Vidhya拆分数据的7种方法Apr 19, 2025 am 10:11 AMLangchain文本拆分器:优化LLM输入以提高效率和准确性 我们上一篇文章介绍了Langchain的文档加载程序。 但是,LLM具有上下文窗口大小的限制(以代币测量)。 超过此限制会截断数据,comp
 免费生成的AI课程:开创创新的未来Apr 19, 2025 am 10:01 AM
免费生成的AI课程:开创创新的未来Apr 19, 2025 am 10:01 AM生成的AI:革命性的创造力和创新 生成的AI通过按下按钮来创建文本,图像,音乐和虚拟世界来改变行业。 它的影响跨越视频编辑,音乐制作,艺术,娱乐,HEA
 使用通用句子编码器和Wikiqa创建QA模型Apr 19, 2025 am 10:00 AM
使用通用句子编码器和Wikiqa创建QA模型Apr 19, 2025 am 10:00 AM利用嵌入模型的力量来回答高级问题 在当今信息丰富的世界中,立即获得精确答案的能力至关重要。 本文展示了使用强大的提问(QA)模型
 前十名必须阅读机器学习研究论文Apr 19, 2025 am 09:53 AM
前十名必须阅读机器学习研究论文Apr 19, 2025 am 09:53 AM本文探讨了十个彻底改变人工智能(AI)和机器学习(ML)的开创性出版物。 我们将研究神经网络和算法的最新突破,并解释驱动现代AI的核心概念。 Th


热AI工具

Undresser.AI Undress
人工智能驱动的应用程序,用于创建逼真的裸体照片

AI Clothes Remover
用于从照片中去除衣服的在线人工智能工具。

Undress AI Tool
免费脱衣服图片

Clothoff.io
AI脱衣机

AI Hentai Generator
免费生成ai无尽的。

热门文章

热工具

Dreamweaver Mac版
视觉化网页开发工具

记事本++7.3.1
好用且免费的代码编辑器

mPDF
mPDF是一个PHP库,可以从UTF-8编码的HTML生成PDF文件。原作者Ian Back编写mPDF以从他的网站上“即时”输出PDF文件,并处理不同的语言。与原始脚本如HTML2FPDF相比,它的速度较慢,并且在使用Unicode字体时生成的文件较大,但支持CSS样式等,并进行了大量增强。支持几乎所有语言,包括RTL(阿拉伯语和希伯来语)和CJK(中日韩)。支持嵌套的块级元素(如P、DIV),

安全考试浏览器
Safe Exam Browser是一个安全的浏览器环境,用于安全地进行在线考试。该软件将任何计算机变成一个安全的工作站。它控制对任何实用工具的访问,并防止学生使用未经授权的资源。

适用于 Eclipse 的 SAP NetWeaver 服务器适配器
将Eclipse与SAP NetWeaver应用服务器集成。






