Nature 하위 저널에 게재된 토폴로지 Transformer 모델은 약물 개발을 지원하기 위한 다중 규모 단백질-리간드 상호작용을 예측합니다.
- 王林원래의
- 2024-07-02 15:23:211205검색

새로운 인공지능 애플리케이션은 연구자들의 약물 개발 역량을 향상시키는 데 도움이 될 것입니다.
이 프로젝트는 TopoFormer라고 불리며 미시간 주립대학교 수학과 Guowei Wei 교수가 이끄는 학제간 팀에 의해 개발되었습니다.
TopoFormer는 분자의 3차원 정보를 일반적인 AI 기반 약물 상호 작용 모델에서 사용할 수 있는 데이터로 변환하여 이러한 모델의 약물 효과 예측 기능을 확장합니다.
생화학 및 분자 생물학과와 전기 및 컴퓨터 공학과에 재직 중인 Wei는 “인공 지능을 사용하면 약물 개발을 더 빠르고 효율적이며 저렴하게 만들 수 있습니다.”라고 말했습니다.
웨이 교수는 미국에서는 약품 개발에 약 10년이 걸리고 약 20억 달러의 비용이 든다고 설명했습니다. 약물 시험에는 약 절반의 시간이 소요되고, 나머지 절반은 테스트할 새로운 치료법을 찾는 데 사용됩니다.
TopoFormer는 개발 시간을 단축할 수 있는 잠재력을 가지고 있습니다. 이를 통해 신약 개발 비용을 절감할 수 있어 하위 소비자의 약가를 낮출 수 있다.
이 연구의 제목은 "단백질-리간드 상호 작용 예측을 위한 다중 규모 토폴로지 지원 구조-시퀀스 변환기"이며 2024년 6월 24일 "Nature Machine Intelligence"에 게재되었습니다.

"우리 몸에는 20,000개가 넘는 단백질이 있습니다." Wei는 "질병이 발생하면 그 중 일부 또는 하나가 표적이 됩니다."
그러면 첫 번째 단계는 이러한 단백질 중 어느 것이 영향을 받는지 이해하는 것입니다. 어떤 단백질에 의해. 이러한 단백질은 또한 질병의 영향을 예방, 완화 또는 대응할 수 있는 분자를 찾고자 하는 연구자들의 표적이 되고 있습니다.
“목표가 있으면 그 특정 목표에 맞는 잠재적인 약물을 많이 찾으려고 노력합니다.”라고 Wei는 말했습니다.
과학자들이 약물이 어떤 단백질을 표적으로 삼아야 하는지 알게 되면, 단백질과 잠재적인 약물의 분자 서열을 전통적인 컴퓨터 모델에 공급할 수 있습니다. 이러한 모델은 약물과 표적이 어떻게 상호 작용하는지 예측하고, 개발을 안내하며, 임상 시험에서 어떤 약물을 테스트할지 예측할 수 있습니다.
이러한 모델은 약물과 단백질의 화학적 구성만을 토대로 일부 상호 작용을 예측할 수 있지만 분자 모양과 3차원 또는 3D 구조에서 발생하는 중요한 상호 작용도 무시합니다.
1960년대 화학자들에 의해 발견된 이부프로펜이 그 예입니다. 화학적 서열은 동일하지만 3D 구조가 약간 다른 두 가지 이부프로펜 분자가 있습니다. 단 하나의 배열만이 통증 관련 단백질에 결합하여 두통을 제거할 수 있습니다.
Guowei Wei는 다음과 같이 말했습니다. "현재의 딥 러닝 모델은 약물이나 단백질이 함께 작동하는 방식을 예측할 때 그 모양을 설명할 수 없습니다."
Transformer 아키텍처는 교차 도메인 순차 데이터 분석을 위해 주의 메커니즘을 활용하는 새로운 기술을 도입합니다. 이에 영감을 받아 Wei 팀은 PTHL(Persistant Topological Hyperdigraph Laplacian)을 Transformer 프레임워크와 통합하는 TopoFormer 토폴로지 Transformer 모델을 개발했습니다.
단백질 및 리간드 서열을 처리하는 기존 Transformer와 달리 TopoFormer는 3D 단백질-리간드 복합체를 입력합니다. 이는 이러한 복합체를 PTHL을 통해 위상 불변 및 동위원소 모양의 시퀀스로 변환하여 여러 규모에서 물리적, 화학적 및 생물학적 상호 작용을 포착합니다.
다양한 데이터세트에 대해 사전 훈련된 TopoFormer는 분자 서열에서 명확하지 않은 입체화학적 효과를 포함하여 복잡한 분자 상호작용을 이해할 수 있습니다. 특정 데이터 세트를 미세 조정하면 전체 데이터 세트와 관련된 컴플렉스 내의 세부 상호 작용 및 특성을 포착할 수 있으므로 다운스트림 딥 러닝 애플리케이션이 향상됩니다.
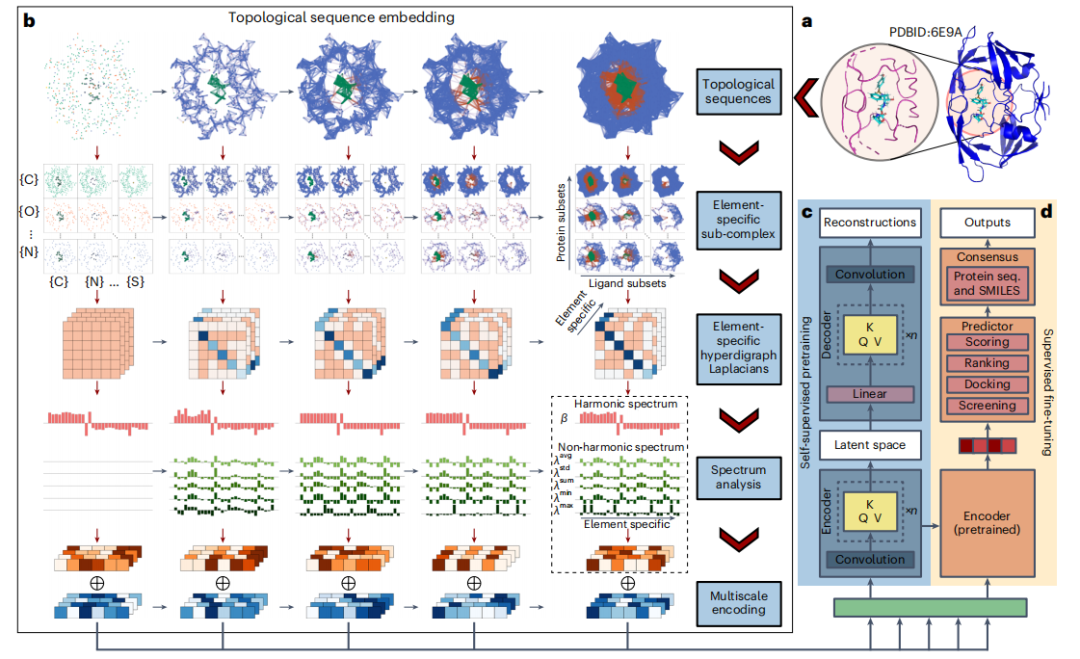
- 분석의 초점을 맞추기 위해 연구자들은 20Å, 더 정확하게는 12Å의 컷오프를 사용하여 설정된 거리 내에서 재배열체와 인근 단백질 원자를 식별합니다.
- 그런 다음 TopoFormer는 다중 규모 분석을 위해 PTHL을 사용하여 위상 서열 임베딩 모듈을 통해 3차원 분자 구조를 위상 서열로 변환합니다. 이 과정은 다양한 물리적, 화학적, 생물학적 상호작용을 벡터 서열에 포함시킵니다.
- TopoFormer는 자가 감독 사전 훈련을 위해 라벨이 지정되지 않은 단백질-리간드 복합체를 사용하고 Transformer 인코더-디코더를 사용하여 토폴로지 시퀀스를 재구성합니다. 이 단계에서는 출력 및 입력 임베딩을 비교하여 정확도를 측정함으로써 레이블이 지정된 데이터가 없는 경우 단백질-리간드 역학을 이해하기 위한 모델을 준비합니다.
- 사전 훈련 후 TopoFormer는 라벨링된 복합체의 감독된 미세 조정 단계에 들어갑니다. 여기서 초기 임베딩 벡터는 채점, 순위 지정, 도킹 및 스크리닝과 같은 다운스트림 작업의 핵심 기능이 됩니다. 각 작업에는 예측 모듈에 전용 헤더가 있습니다.
- 정확성을 보장하고 편향을 줄이기 위해 TopoFormer는 다양한 시드로 초기화된 여러 토폴로지 변환 딥 러닝 모델을 통합하고 시퀀스 기반 모델로 보완합니다.
- 최종 출력은 이러한 다양한 예측에 대한 합의로, TopoFormer는 위상학적 통찰력과 딥 러닝을 모두 활용하여 단백질-리간드 상호 작용을 분석하기 위한 포괄적인 모델이 됩니다.
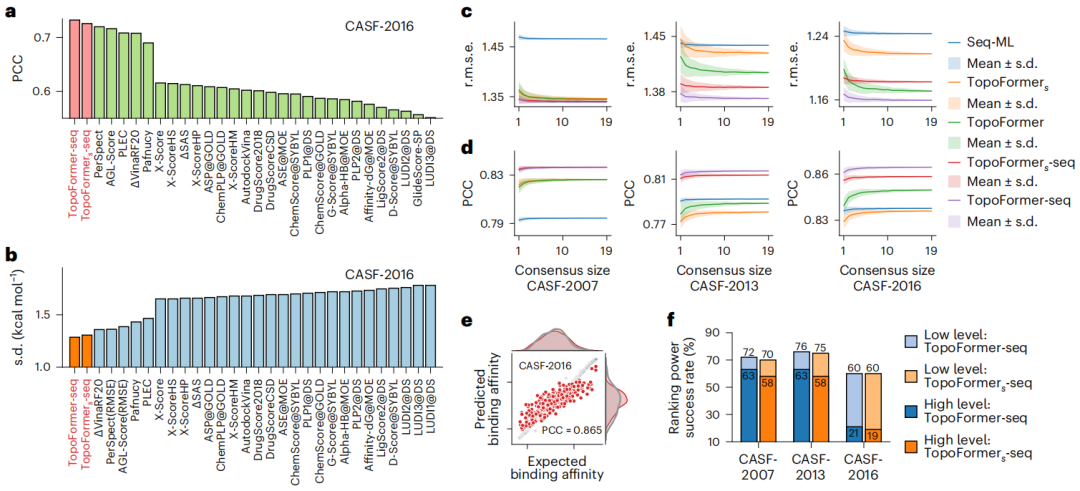
그림: TopoFormer의 점수 매기기 및 순위 지정 작업 성과. (출처: Paper)
이 접근 방식을 사용하면 다양한 차원의 방향성 하이퍼에지를 사용하여 단순한 쌍 연결을 넘어 복잡한 상호 작용을 모델링할 수 있습니다. 또한 이러한 가장자리의 방향은 전기 음성도 및 이온화 에너지와 같은 물리적, 화학적 특성을 결합하여 기존 방법보다 더 미묘한 표현을 제공합니다. 연구자들은 두 개의 B7C2H9 이성질체를 방향성 하이퍼에지(directed hyperedge)로 구별함으로써 이러한 능력을 입증했으며, 원소 구성을 효과적으로 구별하는 방법의 능력을 입증했습니다.
단백질-리간드 복합체를 연구할 때 연구자들은 위상학적 초방향 그래프를 초기 표현으로 채택하고 PTHL 이론으로 이를 더욱 향상시켜 기하학적 및 위상학적 특성을 분석합니다.
0차원 Hoch Laplacian 연산자가 잘 정의된 양자 시스템의 Hamiltonian의 운동 에너지 연산자와 연결된 분자 구조와 같은 물리적 시스템에서 영감을 얻은 연구자들은 이산적 비유를 위상학적 상부 구조에 대한 그래프로 확장합니다. 라플라시안 행렬의 이러한 고유값은 물리적 시스템의 에너지 스펙트럼과 유사한 위상학적 객체의 속성에 대한 통찰력을 제공합니다.
전통적인 영구 상동성과 비교하여 PTHL 방법은 단순 복합체를 넘어 더 넓은 범위의 구조를 분석함으로써 큰 발전을 이루었습니다. 이는 지속적인 라플라시안 연산자의 불협화음 스펙트럼을 통해 Betti 수 및 동위원소 형태 진화를 포함한 기본적인 상동성 정보와 기하학적 통찰력을 포착합니다.
분석 결과, 전통적인 상동성에 비해 더 포괄적인 특성 분석을 제공하는 것으로 나타났습니다. 라플라시안 연산자(베티 수에 해당)의 0 고유값의 다중성은 이 방법에 바코드 정보가 포함되어 있음을 확인하여 단백질-리간드 복합체를 이해하기 위한 강력한 프레임워크를 제공합니다.
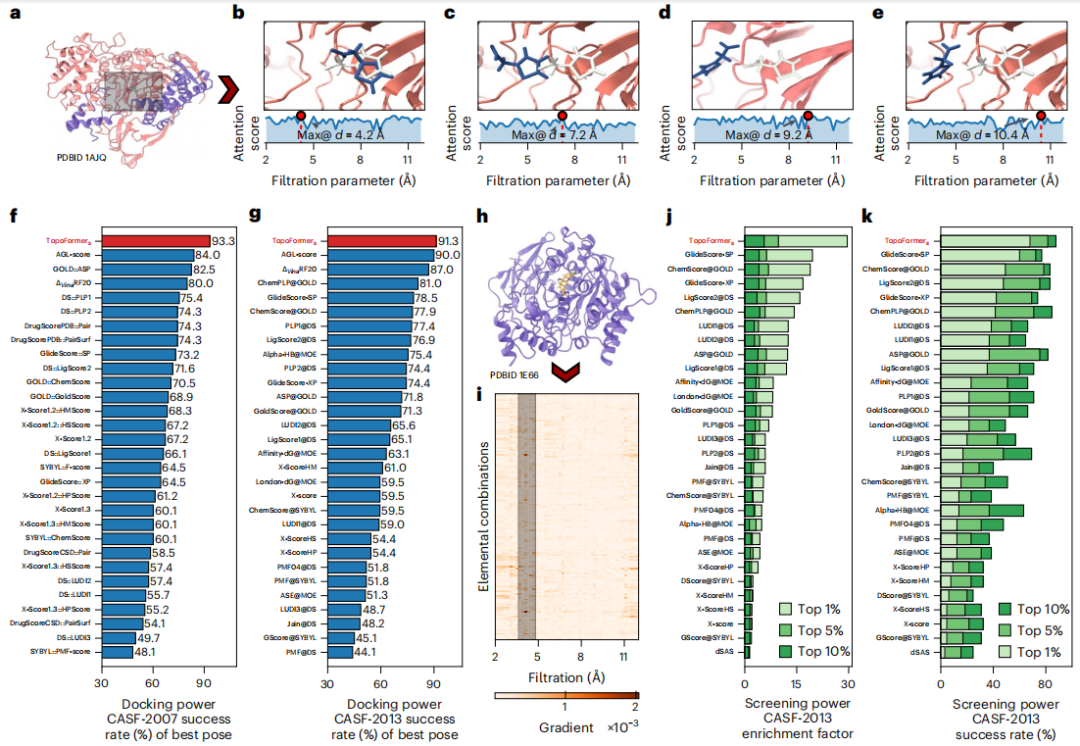
공유 결합, 이온 힘, 반 데르 발스 힘을 포함한 단백질-리간드 복합체의 복잡한 원자 상호 작용을 포착하기 위해 연구원들은 PTHL을 사용하여 다중 규모 분석을 수행했습니다. 이 접근 방식을 사용하면 필터링 매개변수를 기반으로 토폴로지 시퀀스를 발전시켜 교차 규모 상호 작용을 검사할 수 있으므로 Transformer 모델이 결합 친화성과 같은 속성에 각 규모가 부여하는 가중치를 식별하는 데 도움이 됩니다.
수소 결합, 반 데르 발스 힘, π 스태킹을 포함한 원소 상호 작용은 단백질-리간드 복합체의 안정성과 특이성의 기초입니다. 요소 수준에서 이러한 상호 작용을 분석하기 위해 연구진은 위상적 시퀀스 임베딩에 요소별 분석을 도입했습니다.
이 방법은 단백질과 리간드의 일반적인 중원소를 기반으로 하위 하이퍼그래프를 구성하여 복합체 내 상호 작용을 인코딩하는 요소별 라플라시안 행렬을 생성합니다. 이 기술은 단백질-리간드 상호 작용의 복잡한 역학에 대한 Transformer 모델의 이해를 향상시키는 상세한 물리적, 화학적 특징을 추출합니다.
결론
요약하자면 TopoFormer는 한 가지 형태의 정보를 읽고 이를 다른 형태로 변환하도록 훈련되었습니다. 이 경우 단백질과 약물이 모양에 따라 상호작용하는 방식에 대한 3차원 정보를 가져와 현재 모델이 이해할 수 있는 1차원 정보로 재구성합니다.
새 모델은 수만 개의 단백질-약물 상호작용에 대해 훈련되었으며, 여기서 두 분자 사이의 각 상호작용은 코드 조각 또는 "단어"로 기록됩니다. 이 단어들은 서로 연결되어 약물-단백질 복합체에 대한 설명을 형성하고 그 모양에 대한 기록을 만듭니다.
"이렇게 하면 많은 단어가 문장처럼 엮여 있어요." 웨이가 말했습니다.
새로운 약물 상호 작용을 예측하는 다른 모델은 이러한 문장을 읽고 더 많은 맥락을 제공할 수 있습니다. 신약이 책이었다면 TopoFormer는 대략적인 이야기 아이디어를 완전한 줄거리로 바꾸어 바로 쓸 수 있도록 할 수 있습니다.
논문 링크: https://www.nature.com/articles/s42256-024-00855-1
관련 보도: https://phys.org/news/2024-06-drug-discovery-ai-3d See More -전형적인.html
위 내용은 Nature 하위 저널에 게재된 토폴로지 Transformer 모델은 약물 개발을 지원하기 위한 다중 규모 단백질-리간드 상호작용을 예측합니다.의 상세 내용입니다. 자세한 내용은 PHP 중국어 웹사이트의 기타 관련 기사를 참조하세요!