Heim >Technologie-Peripheriegeräte >KI >Melden Sie sich bei Science an, die Arzneimittelaffinität ist um das 37-fache gestiegen, die KI führt eine unbeaufsichtigte Optimierung von Protein- und Antikörperkomplexen durch
Melden Sie sich bei Science an, die Arzneimittelaffinität ist um das 37-fache gestiegen, die KI führt eine unbeaufsichtigte Optimierung von Protein- und Antikörperkomplexen durch
- 王林Original
- 2024-07-18 22:22:51841Durchsuche

Proteine sind an vielen biologischen Funktionen wie der Zellzusammensetzung, der Muskelkontraktion, der Verdauung von Nahrungsmitteln und der Identifizierung von Viren beteiligt.
Um bessere Proteine (einschließlich Antikörper) zu entwickeln, mutieren Wissenschaftler häufig wiederholt Aminosäuren (indem sie die Einheiten, aus denen Proteine bestehen, in einer bestimmten Reihenfolge anordnen) an verschiedenen Positionen, bis das Protein die erforderliche Funktion erhält.
Aber es gibt mehr Aminosäuresequenzen als Sandkörner auf der Welt, daher ist es oft schwierig, das beste Protein und damit das beste potenzielle Medikament zu finden. Angesichts dieser Herausforderung geben Wissenschaftler oft Millionen von Dollar aus und testen miniaturisierte, vereinfachte Versionen biologischer Systeme.
„Dies erfordert viel Rätselraten und Verifizierung.“ Brian L. Hie, Assistenzprofessor für Chemieingenieurwesen an der Stanford University und Innovationsstipendiat am Arc Institute, sagte: „Das Ziel vieler intelligenter Algorithmen besteht darin, das Rätselraten zu beseitigen.“
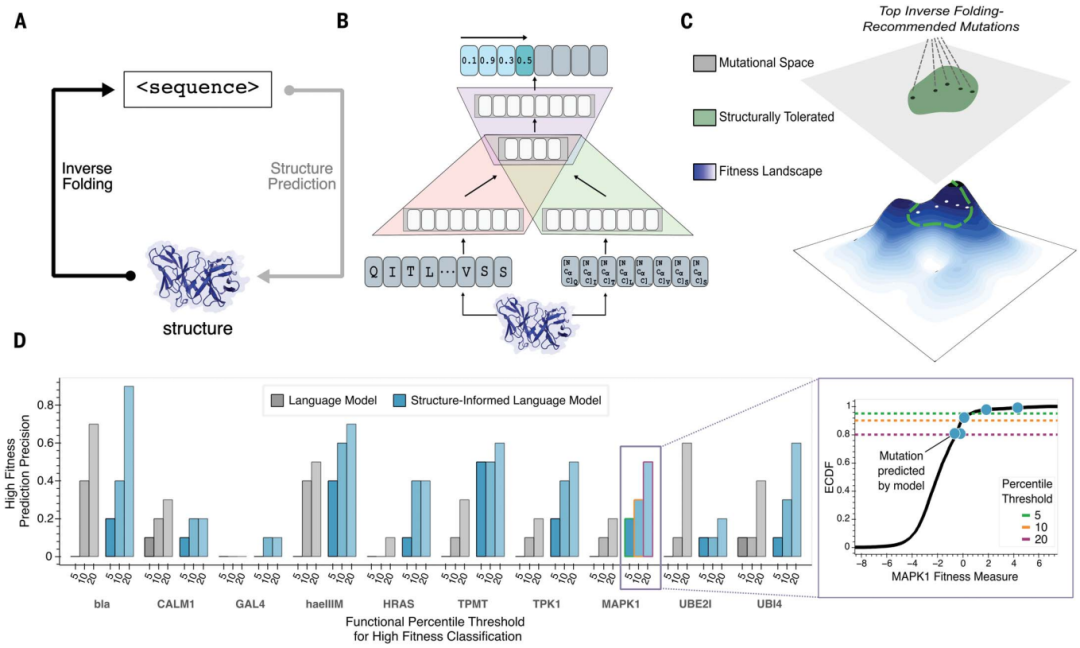
Wissenschaftler der Stanford University haben eine neue Methode entwickelt, die auf maschinellem Lernen basiert und molekulare Veränderungen, die zu besseren Antikörpermedikamenten führen, schneller und genauer vorhersagen kann. Durch die Kombination der 3D-Struktur des Proteinrückgrats mit einem großen Sprachmodell basierend auf der Aminosäuresequenz konnten die Forscher innerhalb von Minuten seltene und wünschenswerte Mutationen finden.
Die Studie trug den Titel „Unüberwachte Evolution von Protein- und Antikörperkomplexen mit einem strukturinformierten Sprachmodell“ und wurde am 4. Juli 2024 in „Science“ veröffentlicht.

Große Sprachmodelle, die ausschließlich auf Sequenzinformationen trainiert werden, können hochrangige Prinzipien des Proteindesigns erlernen. Neben der Sequenz bestimmt jedoch auch die dreidimensionale Struktur von Proteinen ihre spezifische Funktion, Aktivität und Evolvierbarkeit.
Für Probleme bei der Antikörpertechnik verwendeten Forscher der Stanford University strukturell informierte Proteinsprachmodelle, um Sequenzen mit hoher Fitness vorherzusagen, die durch bekannte Antikörper- oder Antikörper-Antigen-Komplexstrukturen eingeschränkt sind.
Untersuchungen zeigen, dass ein universelles Protein-Sprachmodell, ergänzt um Protein-Strukturkoordinaten, die Entwicklung verschiedener Proteine steuern kann, ohne dass einzelne Funktionsaufgaben modelliert werden müssen.
-
Strukturgesteuertes Paradigma:
- modelliert keine explizite Definition der Proteinfunktion oder -fitness.
- Konzentrieren Sie sich auf Regionen, in denen die Proteinrückgratfaltung erhalten bleibt, und erkunden Sie indirekt die Fitnesslandschaft.
- Angenommen, die Entwicklung innerhalb eines Bereichs mit hoher Sequenzwahrscheinlichkeit ist ein gültiger Prior für Varianten mit hoher Fitness.
-
Breite Anwendung:
- kann indirekt die Fitnesslandschaft von Proteinen in verschiedenen Umgebungen untersuchen, wie z. B. Enzymkatalyse, Antibiotikaresistenz und Chemotherapieresistenz.
-
Proteinkomplexdesign:
- ESM-IF1, das nur auf Einzelkettenstrukturen trainiert wurde, kann zum Design von Proteinkomplexen erweitert werden.
- Zeigt, dass strukturelle Informationssprachmodelle implizit lernen können, Merkmale zu kombinieren und auf Polyproteine zu verallgemeinern.
-
Entwicklung menschlicher Antikörper:
- Diese Methode ist besonders wertvoll für die Entwicklung menschlicher Antikörper und kann zur Behandlung einer Vielzahl von Krankheiten eingesetzt werden.
- Antikörper bieten Schutz, indem sie an Zielantigene binden.
-
Große Datenmengen ersetzen:
- Strukturen können große Datenmengen ersetzen und der Computer kann trotzdem lernen.
- Mehr Antikörper bieten Optimierungsmöglichkeiten.
-
Gerichtete Evolution:
- Diese Methode wird verwendet, um gerichtete Evolutionsaktivitäten mehrerer Proteine experimentell zu steuern.
- Generieren Sie Designs mit einer funktionellen Aktivität, die Wildtyp-Proteinen überlegen ist.
- Keine Notwendigkeit, gekennzeichnete Fitnessdaten zu analysieren oder eine aufgabenspezifische Modellüberwachung durchzuführen.
Abbildung: Die Entwicklung von Antikörpern mithilfe struktureller Informationssprachenmodelle kann die neutralisierende Wirksamkeit und Widerstandsfähigkeit verbessern. (Quelle: Papier)
Mit dieser Methode untersuchte das Team etwa 30 Kandidaten auf zwei therapeutische klinische Antikörper zur Behandlung schwerer Varianten des akuten respiratorischen Syndroms Coronavirus 2 (SARS-CoV-2). Gleichzeitig erreichten die Forscher eine 25-fache Steigerung der Neutralisierung und eine 37-fache Steigerung der Affinität gegen die Antikörper-Escape-Virusvarianten BQ.1.1 und XBB.1.5.
Zusammenfassend lässt sich sagen: Dieses Tool hilft dabei, schnell auf neue oder sich entwickelnde Krankheiten zu reagieren. Es senkt auch die Hürden für die Herstellung wirksamerer Medikamente. Stärkere Medikamente bedeuten, dass geringere Dosen erforderlich sind, sodass mehr Patienten von einer bestimmten Dosis profitieren können.
Link zum Papier: https://www.science.org/doi/10.1126/science.adk8946
Verwandte Berichte: https://phys.org/news/2024-07-ai-approach-optimizes- Antikörper-Medikamente.html
Das obige ist der detaillierte Inhalt vonMelden Sie sich bei Science an, die Arzneimittelaffinität ist um das 37-fache gestiegen, die KI führt eine unbeaufsichtigte Optimierung von Protein- und Antikörperkomplexen durch. Für weitere Informationen folgen Sie bitte anderen verwandten Artikeln auf der PHP chinesischen Website!
In Verbindung stehende Artikel
Mehr sehen- Technologietrends, die Sie im Jahr 2023 im Auge behalten sollten
- Wie künstliche Intelligenz Rechenzentrumsteams neue Alltagsaufgaben beschert
- Können künstliche Intelligenz oder Automatisierung das Problem der geringen Energieeffizienz in Gebäuden lösen?
- OpenAI-Mitbegründer im Interview mit Huang Renxun: Die Argumentationsfähigkeiten von GPT-4 haben noch nicht die Erwartungen erfüllt
- Dank der OpenAI-Technologie übertrifft Bing von Microsoft Google im Suchverkehr


