AI从头设计蛋白质「开关」,蛋白质设计的惊人突破,David Baker研究登Nature
- 王林原创
- 2024-08-20 13:41:30774浏览

Im Leben ist es einfach, ein Licht einzuschalten oder die Lichter anzupassen. Doch Systeme, die eine ähnliche Kontrolle biomolekularer Funktionen erreichen, sind komplex und wenig verstanden.
In der Biologie werden Proteinfunktionen auf komplexe Weise ein- und ausgeschaltet. Dies ist einer der wichtigen biologischen Regulierungsmechanismen und entscheidend für einen gesunden Stoffwechsel und die Zellsignalisierung. Aber die Herstellung von Allosterie in synthetischen Proteinsystemen war schon immer mit großen Herausforderungen verbunden.
Kürzlich hat das Team von David Baker an der University of Washington ein Protein entwickelt, das durch allosterische Kontrolle zuverlässig und genau zwischen Auf- und Abbau wechseln kann. Forscher haben mithilfe von KI neue Proteine entworfen, die in der Natur nicht vorkommen, und dabei mehrere dynamische Proteinanordnungen entworfen.
David Baker sagte: „Durch die Entwicklung von Proteinen, die auf Befehl zusammengesetzt und zerlegt werden können, ebnen wir den Weg für zukünftige Biotechnologien, die mit der Komplexität der Natur mithalten können.“ Arvind Pillai, Erstautor und korrespondierender Autor des Papiers, sagte: „Eine der wichtigsten Innovationen dieser Studie ist das Design von Proteinanordnungen, die als Reaktion auf Effektormoleküle zwischen verschiedenen Oligomerzuständen wie Dimeren, Ringen und Käfigen wechseln können.“ „Diese Fähigkeit, die Proteinstruktur fernzusteuern, eröffnet die Möglichkeit, adaptive Biomaterialien und Arzneimittelabgabesysteme zu entwickeln. Ein atemberaubender Durchbruch im Design.“
Die entsprechende Forschung trug den Titel „De novo design of allosterically switchable protein assemblies“ und wurde am 14. August in „Nature“ veröffentlicht.
Allosterie und De-novo-DesignPapierlink: https://www.nature.com/articles/s41586-024-07813-2#🎜 🎜 #
- Allosterische Regulation#🎜🎜 # bezeichnet.
De-novo-entworfene Proteine erweitern das Repertoire natürlich entwickelter Eigenschaften und öffnen die Tür für eine besser kontrollierbare Kontrolle der Proteinfunktion.
- Inspiration: Monod-Wyman-Changeux (MWC)-Kollaborationsmodell
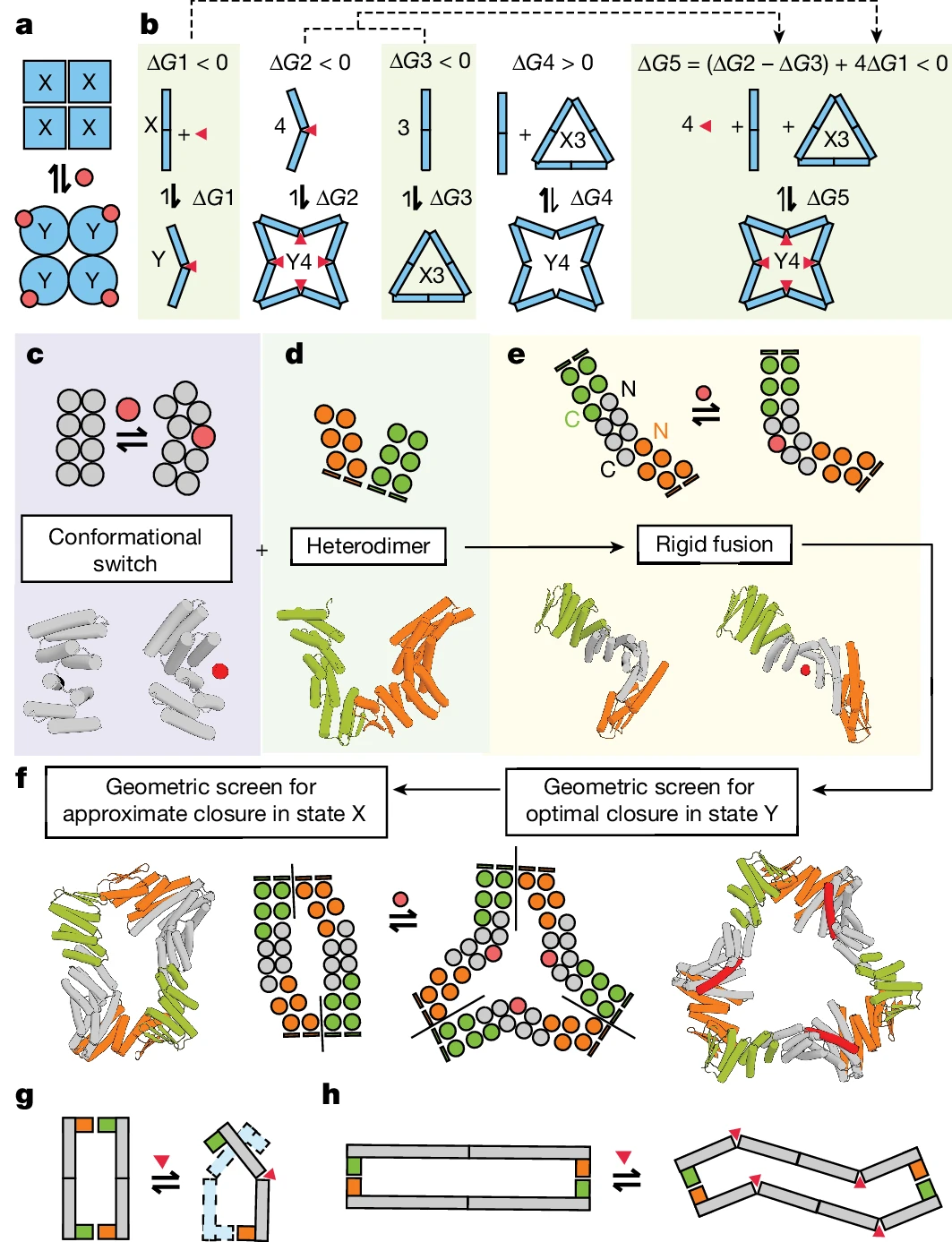
Inspiriert durch das MWC-Kollaborationsmodell sind Forscher durch Starrkörperkopplung schaltbar Scharniermodule und Proteinschnittstellen zum Design von Grund auf
allosteric- .
Verwenden Sie das MWC-Modell als Ausgangspunkt für Design
- Verwenden Sie Protein Strukturvorhersage-Tools# 🎜🎜# Design
- Proteinmodule auf strukturell und energetisch machbare Weise nähen
- #🎜 🎜##🎜 🎜#Illustration:
- Designstrategien für den Aufbau schaltbarer Oligomere. (Quelle: Papier)
- Forschungsergebnisse:
Forscher demonstrierten die Anwendung von RFdiffusion, ProteinMPNN und anderen Designtools, z Es entsteht eine Reihe dynamischer und konformativ wechselnder Proteinanordnungen. Durch die Kombination von Zwei-Zustands-Scharnieren und maßgeschneiderten Protein-Protein-Interaktionsmodulen unterscheiden sich die resultierenden Anordnungen erheblich von allen bisher gesehenen und erweitern die Möglichkeiten der synthetischen Biologie. Schlüsselinnovation:
Schlüsselinnovation:
Eine Schlüsselinnovation in dieser Forschung ist das Design von Proteinanordnungen. Zusätzlich zur strukturellen Vielseitigkeit erreichte das Team auch eine hochaffine Bindung zwischen dem neuen Protein und seinen Effektoren, was eine zuverlässige programmierte allosterische Kontrolle gewährleistet. „Für dieses Projekt haben wir spezifische Peptide als Effektoren verwendet, aber jede Art von Molekül kann bei der Proteinallosterie unter den richtigen Bedingungen verwendet werden“, fügte Co-Autor Abbas Idris, ein Doktorand an der University of Washington, hinzu.
Illustration: Entwurf einer allosterisch kontrollierten zyklischen Anordnung. (Quelle: Papier)
Die Forscher synthetisierten eine Reihe entworfener Proteine und charakterisierten anschließend das Schaltverhalten, das durch die Proteinstruktur und die Bindung von Effektormolekülen verursacht wird. Fast 40 % der synthetischen Proteine, die für den Wechsel zwischen Ringanordnungen mit unterschiedlicher Anzahl von Protomeren konzipiert sind, sind wasserlöslich und weisen die erwartete Protomer-Stöchiometrie auf. Darüber hinaus folgt die Anzahl der an ein Protein gebundenen Effektoren dem MWC-Modell: Alle Bindungsstellen sind gefüllt oder gar keine. Mit anderen Worten: Die homologe Effektorbindung ist äußerst kooperativ und die resultierende Anordnung enthält keine Mischung aus R- und T-Protomeren.
图示:根据设计在组装状态之间切换的蛋白质。(来源:Nature)更进一步,研究人员设计了包含双铰链(两个铰链由短环连接)的蛋白质,目的是制造出在不改变蛋白质组装体中原聚体数量的情况下响应效应物结合而改变其 3D 结构的蛋白质。果然,这些蛋白质发挥了预期的作用,从而重现了自然存在的变构蛋白质(如血红蛋白)的主导行为。最后,研究人员还设计了在与效应分子结合时组装或拆卸的原聚体。
研究设计的特定从头蛋白质组装体包括由两个单体二聚化形成的环,组装后会触发光输出,用于生物传感应用,以及笼状结构,它们经过受控拆卸,用于释放有效载荷以进行药物输送。这些蛋白质动力学通过尺寸排阻色谱法、质谱法和电子显微镜在体外进行了实验验证。
Pillai 强调,环状结构表现出额外的精确特性,例如协同性,这是自然系统(例如血液蛋白、血红蛋白)所表现出的一种现象。在协同系统中,一种分子的结合会增强其他分子的结合,从而产生快速的开关式反应,这对于精确控制至关重要,例如在肺部捕获氧气并将氧气释放到组织中。
「从历史上看,在实验室中,我们做了很多工作来控制结合某种物质的亲和力,例如将其结合得越来越紧密。但这并不是与生物系统相关的唯一方面,」Pillai 说。「有时你希望能够在非常窄的浓度范围内结合。」
为了验证设计,研究人员使用阴性染色和低温电子显微镜对 20 多个蛋白质组装体进行了表征。「这使我们能够确认哪些设计是按预期形成的,并观察这些组装体在引入效应分子时如何改变其结构,」IPD 电子显微镜研究核心负责人 Andrew Borst 博士解释说。

研究观察到效应结合位点和组装界面之间的变构耦合,距离大于一纳米,从原子角度来看这是一个巨大的跨度。这种广泛的耦合对于创建模仿甚至可能超越自然界的复杂蛋白质行为至关重要。
潜在应用
设计的组件包括可远程打开和关闭的纳米级容器。这样的系统可能导致具有先进控制机制的新型药物输送载体,包括隔离细胞杀伤药物直到它们遇到肿瘤的装置。
该研究为设计变构控制的功能铺平了道路,超越了蛋白质组装和拆卸,例如调节酶活性以实现代谢功能和可以将能量转化为机械功的纳米机器,类似于负责细胞运动的蛋白质肌动蛋白和肌球蛋白。
「下一步是确定我们是否能够与小分子形成相互作用并准确催化反应,这对整个领域来说是一个更具挑战性的前沿。」Pillai 说。
展望未来,研究团队寻求在更广泛的生物学背景下评估这些工程蛋白质动力学。未来的工作包括在组织培养中将这些设计功能安装在细胞表面,为治疗学(如过继细胞疗法)中的反馈控制提供有价值的工具。
参考内容:
- https://www.bakerlab.org/2024/08/14/morphing-protein-assemblies-by-design/
- https://www.genengnews.com/topics/artificial-intelligence/ai-designed-proteins-morph-on-demand-for-steerable-functionality/
- https://www.nature.com/articles/d41586-024-02242-7
以上是AI从头设计蛋白质「开关」,蛋白质设计的惊人突破,David Baker研究登Nature的详细内容。更多信息请关注PHP中文网其他相关文章!