AI는 처음부터 단백질 '스위치'를 설계합니다. 이는 단백질 설계의 놀라운 혁신입니다. David Baker의 연구는 Nature에 게재되었습니다.
- 王林원래의
- 2024-08-20 13:41:30750검색

생활 속에서 불을 켜거나 조절하는 것은 쉽습니다. 그러나 생체분자 기능의 유사한 제어를 달성하는 시스템은 복잡하고 잘 이해되지 않습니다.
생물학에서 단백질 기능은 복잡한 방식으로 켜지고 꺼집니다. 알로스테릭 조절은 중요한 생물학적 조절 메커니즘 중 하나이며 건강한 신진대사와 세포 신호 전달에 중요합니다. 그러나 합성 단백질 시스템에서 알로스테리를 생성하는 것은 항상 중요한 과제를 안겨주었습니다.
최근 워싱턴 대학의 데이비드 베이커 팀은 알로스테릭 제어를 통해 조립과 분해 사이를 안정적이고 정확하게 전환할 수 있는 단백질을 설계했습니다. 연구자들은 AI를 사용하여 자연에 존재하지 않는 새로운 단백질을 설계하고 여러 동적 단백질 배열을 설계했습니다.
David Baker는 "명령에 따라 조립 및 분해가 가능한 단백질을 설계함으로써 자연의 복잡성에 맞설 수 있는 미래 생명공학의 길을 닦고 있습니다."라고 말했습니다. 논문의 제1저자이자 교신저자인 Arvind Pillai는 다음과 같이 말했습니다. "이 연구의 주요 혁신 중 하나는 이량체, 고리 및 케이지와 같은 다양한 올리고머 상태 사이를 전환할 수 있는 단백질 어셈블리의 설계입니다. 이펙터 분자에 반응합니다. , 단백질 구조를 원격으로 제어하는 이러한 능력은 적응형 생체재료 및 약물 전달 시스템 개발의 가능성을 열어줍니다."
관련 연구는 "De novo design of allosterically switchable Protein assemblies"라는 제목으로 "Nature" 8월 14일자에 게재되었습니다.
Allostery 및 de novo 디자인Paper 링크: https://www.nature.com/articles/s41586-024-07813-2#🎜 🎜 #
- 알로스테릭 조절#🎜🎜 #이라고 합니다.
De novo 디자인된 단백질은 자연적으로 진화된 특성의 레퍼토리를 확장하여 단백질 기능을 보다 제어 가능하게 제어할 수 있는 가능성을 열어줍니다.
- 영감: Monod-Wyman-Changeux(MWC) 협업 모델
MWC 협업 모델에서 영감을 받아 연구자는 강체 결합을 통해 전환 가능 처음부터 디자인할 수 있는 힌지 모듈 및 단백질 인터페이스
allosteric- .
MWC 모델을 디자인의 출발점으로 사용
- 단백질 활용 구조 예측 도구# 🎜🎜# Design
- 구조적, 에너지적으로 실현 가능한 방식으로 단백질 모듈 봉제
- #🎜 🎜##🎜 🎜#Illustration:
- 전환 가능한 올리고머 구축을 위한 설계 전략. (출처: 논문)
- 연구 결과:
연구원들은 RFdiffusion, ProteinMPNN 및 기타 설계 도구의 적용을 시연했습니다. 일련의 동적 및 구조적 전환 단백질 어셈블리를 생성합니다. 2상태 힌지와 맞춤형 단백질-단백질 상호작용 모듈을 결합함으로써 생성된 어셈블리는 이전에 본 것과 크게 다르며 합성 생물학의 가능성을 확장합니다.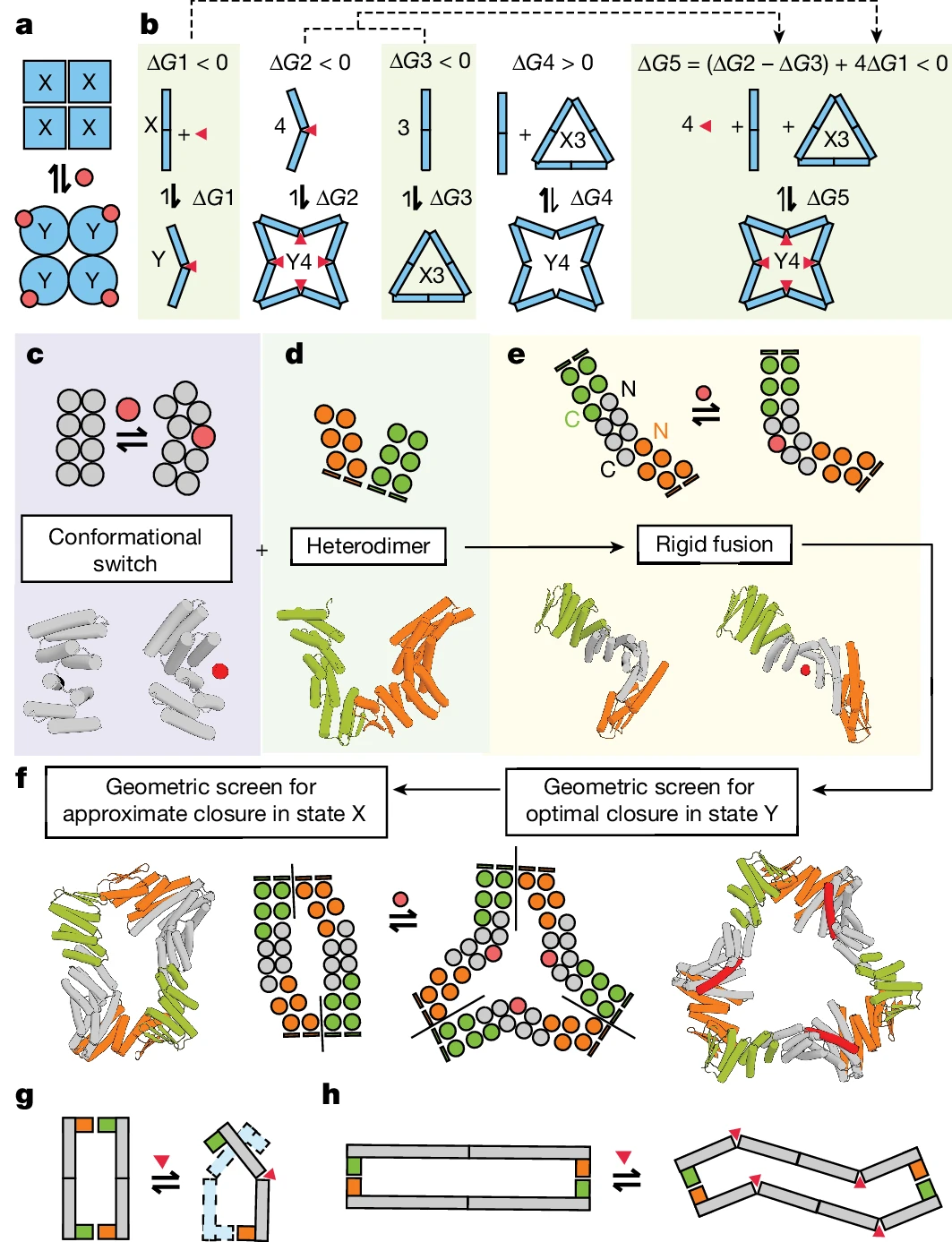 주요 혁신:
주요 혁신:
이 연구의 핵심 혁신은 단백질 어셈블리의 설계입니다. 구조적 다양성 외에도 팀은 새로운 단백질과 그 효과기 사이의 높은 친화력 결합을 달성하여 신뢰할 수 있는 프로그램된 알로스테릭 제어를 보장했습니다. "이 프로젝트에서 우리는 특정 펩타이드를 효과기로 사용했지만 올바른 조건에서 단백질 합금에 어떤 유형의 분자도 사용될 수 있습니다"라고 공동 저자이자 워싱턴 대학 대학원생인 Abbas Idris가 덧붙였습니다.
Illustration: 알로스테릭 제어 순환 어셈블리 설계. (출처: 논문)
연구원들은 다수의 설계된 단백질을 합성한 다음 단백질 구조와 이펙터 분자의 결합으로 인한 전환 동작을 특성화했습니다. 다양한 수의 프로토머로 구성된 고리 어셈블리 사이를 전환하도록 설계된 합성 단백질의 거의 40%는 수용성이며 예상되는 프로토머 화학량론을 나타냅니다. 또한, 단백질에 결합된 이펙터의 수는 MWC 모델을 따릅니다. 즉, 모든 결합 부위가 채워지거나 전혀 채워지지 않습니다. 즉, 동종 이펙터 결합은 매우 협력적이며 결과 어셈블리에는 R 및 T 프로토머의 혼합물이 포함되어 있지 않습니다.
그림: 단백질은 설계에 따라 조립 상태 사이를 전환합니다. (출처: Nature)연구진은 한 단계 더 나아가 단백질의 프로토머 수에 변화가 없는 단백질을 생성하기 위해 이중 경첩(짧은 고리로 연결된 두 개의 경첩)을 포함하는 단백질을 설계했습니다. 단백질 조립. 이펙터 결합에 반응하여 3D 구조를 변경하는 단백질입니다. 물론, 이들 단백질은 예상대로 기능하여 헤모글로빈과 같은 자연 발생 알로스테릭 단백질의 지배적인 행동을 재현했습니다. 마지막으로, 연구자들은 효과기 분자에 결합될 때 조립되거나 분해되는 프로토머도 설계했습니다.
연구에서 설계된 특정 de novo 단백질 어셈블리에는 두 단량체의 이량체화에 의해 형성된 고리가 포함되어 있으며, 조립 시 바이오센싱 응용 분야에 대한 광 출력을 유발하고 분해가 제어되는 케이지형 구조가 있습니다. 약물 전달을 위한 페이로드를 방출합니다. 이러한 단백질 역학은 크기 배제 크로마토그래피, 질량 분석법 및 전자 현미경을 통해 시험관 내에서 실험적으로 검증되었습니다.
Pillai는 고리 구조가 자연 시스템(예: 혈액 단백질, 헤모글로빈)에서 나타나는 현상인 협동성과 같은 추가 정밀 특성을 나타낸다고 강조했습니다. 시너지 시스템에서는 한 분자의 결합이 다른 분자의 결합을 강화하여 폐에서 산소를 포착하여 조직으로 방출하는 등 정밀 제어에 중요한 신속한 온-오프 반응을 생성합니다.
"역사적으로 실험실에서는 물질을 점점 더 단단하게 결합하는 등 물질 결합의 친화성을 제어하기 위해 많은 작업을 수행해 왔습니다. 그러나 생물학적 시스템에서는 그렇지 않습니다. 관련된 유일한 측면입니다.”라고 Pillai는 말했습니다. "때때로 매우 좁은 농도 범위에서 결합할 수 있기를 원합니다."
디자인을 검증하기 위해 연구원들은 음성 염색 및 저온 전자 현미경을 사용하여 20개 이상의 단백질 어셈블리를 특성화했습니다. IPD 전자현미경 연구 핵심 책임자인 Andrew Borst 박사는 "이를 통해 예상대로 어떤 디자인이 형성되었는지 확인하고 이펙터 분자가 도입되었을 때 이러한 어셈블리가 구조를 어떻게 변경했는지 관찰할 수 있었습니다."라고 설명했습니다.

이 연구는 이펙터 결합 부위와 조립 인터페이스 사이의 알로스테릭 결합을 관찰했는데, 이는 원자 관점에서 보면 엄청난 범위인 1나노미터보다 더 먼 거리입니다. 이러한 광범위한 결합은 자연을 모방하거나 심지어 능가하는 복잡한 단백질 행동을 생성하는 데 중요합니다.
잠재적 응용프로그램
설계된 구성 요소에는 원격으로 열고 닫을 수 있는 나노 크기의 용기가 포함되어 있습니다. 이러한 시스템은 종양이 발생할 때까지 세포 살해 약물을 격리하는 장치를 포함하여 고급 제어 메커니즘을 갖춘 새로운 약물 전달 수단으로 이어질 수 있습니다.
이 연구는 대사 기능을 달성하기 위해 효소 활동을 조절하고 단백질의 액틴과 에너지를 기계적인 작업으로 변환할 수 있는 나노머신과 같이 단백질 조립 및 분해를 넘어 알로스테릭으로 제어되는 기능을 설계할 수 있는 길을 열었습니다. 세포 이동을 담당하는 미오신.
"다음 단계는 작은 분자와 상호 작용을 형성하고 반응을 정확하게 촉매할 수 있는지 여부를 결정하는 것입니다. 이는 전체 분야에서 더욱 어려운 개척 과제입니다."라고 Pillai는 말했습니다.
앞으로 연구팀은 더 넓은 생물학적 맥락에서 이러한 가공된 단백질 역학을 평가하려고 합니다. 향후 연구에는 조직 배양의 세포 표면에 이러한 공학적 기능을 설치하여 입양 세포 치료와 같은 치료법의 피드백 제어를 위한 귀중한 도구를 제공하는 것이 포함됩니다.
참고 내용:
- https://www.bakerlab.org/2024/08/14/morphing-단백질-assemblies-by-design/# 🎜🎜# https://www.genengnews.com/topics/artificial-intelligence/ai-designed-단백질-morph-on-demand-for-steerable-functionity/
- https ://www.nature.com/articles/d41586-024-02242-7
위 내용은 AI는 처음부터 단백질 '스위치'를 설계합니다. 이는 단백질 설계의 놀라운 혁신입니다. David Baker의 연구는 Nature에 게재되었습니다.의 상세 내용입니다. 자세한 내용은 PHP 중국어 웹사이트의 기타 관련 기사를 참조하세요!

