ホームページ >テクノロジー周辺機器 >AI >中国のチームががん患者に適した薬剤を予測するAIの開発に成功し、その結果がネイチャーサブジャーナルに掲載された。
中国のチームががん患者に適した薬剤を予測するAIの開発に成功し、その結果がネイチャーサブジャーナルに掲載された。
- PHPz転載
- 2023-04-20 21:43:121349ブラウズ
たった 1 つの AI で、9,808 人のがん患者の薬剤に対する臨床反応を完全に予測できます。
そして、結果は臨床観察と一致しています。
これは、ニューヨーク市立大学の Lei Xie のチームによってもたらされた CODE-AE (コンテキスト認識型脱交絡オートエンコーダー) の最新の成果です。

これは、薬物に対するさまざまな患者の特定の反応を予測できる、新しいコンテキスト自動エンコード モデルを提案します。
これは新薬開発と臨床試験に重大な影響を及ぼします。
従来のモデルでは、新薬の開発、試験、完全市販までに 10 年近くかかり、消費される資金は前例のない巨額で、ゆうに 10 億米ドルに達することを知っておく必要があります。
新薬の人体での反応は予測が難しく、テストには繰り返しの試行が必要になることが多いため、サイクルが非常に長くなります。
AI がデータを使用して予測できるようになれば、新薬の市場投入までの時間が大幅に短縮され、コストが削減されます。
現在、この研究はNatureサブジャーナル「Nature Machine Intelligence」に掲載されています。
簡単に言うと、CODE-AE は、新薬の in vitro 細胞検証のデータを使用して、人体内での薬剤の反応を予測します。
これにより、AI モデルのトレーニングが患者の臨床データに依存することが回避されます。
これまで AI が臨床反応予測にあまり効果的でなかった最大の理由は、大量かつ継続的な臨床反応データを収集することが難しすぎるためです。
メカニズムの観点から、研究者は薬物バイオマーカーをソースドメインとターゲットドメインに分割します。
ソース ドメインはテスト サンプルとは異なるドメインを表しますが、インビトロ細胞検証データとして理解できる豊富な監視情報が含まれています。
ターゲット ドメインは、テスト サンプルが配置されているドメインであり、ラベルがないか、少数のラベルしかありません (患者データ)。
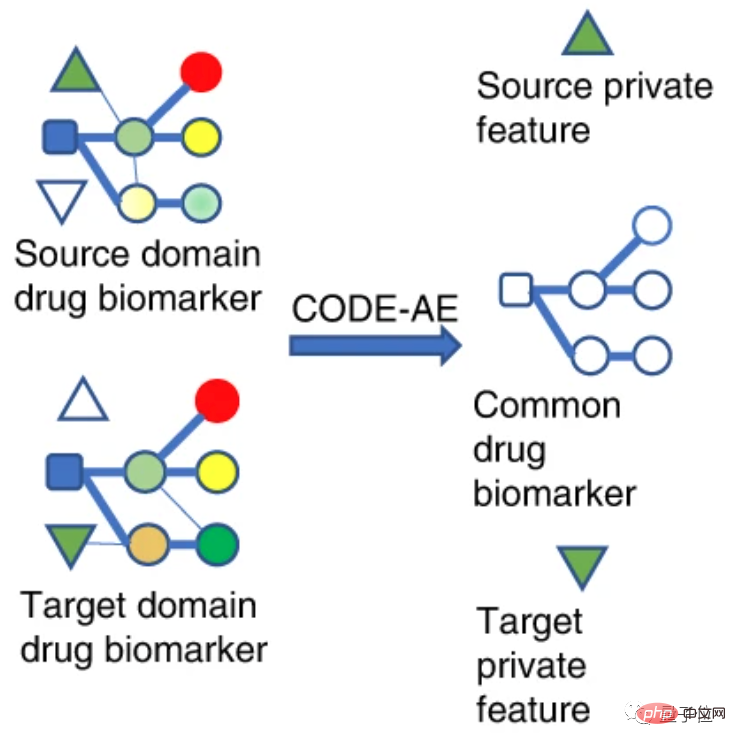
異なるフィールドのデータ特徴を同じ特徴空間にマッピングして、この空間内での距離ができるだけ近くなるようにします。
したがって、特徴空間内のソース ドメインでトレーニングされた目的関数をターゲット ドメインに転送して、ターゲット ドメインの精度を向上させることができます。
この研究の文脈では、ソースドメインとターゲットドメインは両方とも薬物バイオマーカーのデータ特性、つまり薬物ターゲットのデータ特性です。
モデル フレームワークを具体的に見ると、主に事前トレーニング、微調整、推論の 3 つの部分に分かれています。
事前トレーニングでは主に自己教師あり学習を使用して、インビトロ細胞データと患者データの標識されていない遺伝子発現プロファイルを埋め込み空間にマッピングする特徴エンコードモジュールを構築します。このようにして、いくつかの交絡因子を排除し、2 つのデータの潜在的な分布を一貫して系統的な偏りを排除することができます。
微調整段階では、事前トレーニングに基づいて教師ありモデルを追加し、ラベル付きの in vitro 細胞データをトレーニングに使用します。
最後に、推論段階では、事前トレーニングから取得した患者が最初に曖昧さが解消されて埋め込まれ、次に調整されたモデルを使用して薬物に対する患者の反応が予測されます。

このモードでは、CODE-AE には 2 つの特徴があります。
まず、インコヒーレントなサンプルに含まれる共通の生物学的信号とプライベートな表現を抽出できるため、さまざまなデータ パターンによって引き起こされる干渉を排除できます。
第二に、薬物応答シグナルと交絡因子を分離した後、局所的なアライメントも達成できます。
要約すると、CODE-AE は、ラベル付きデータとラベルなしデータのインコヒーレントなデータ パターン埋め込み空間内で固有の特徴を選択するプロセスとして理解できます。
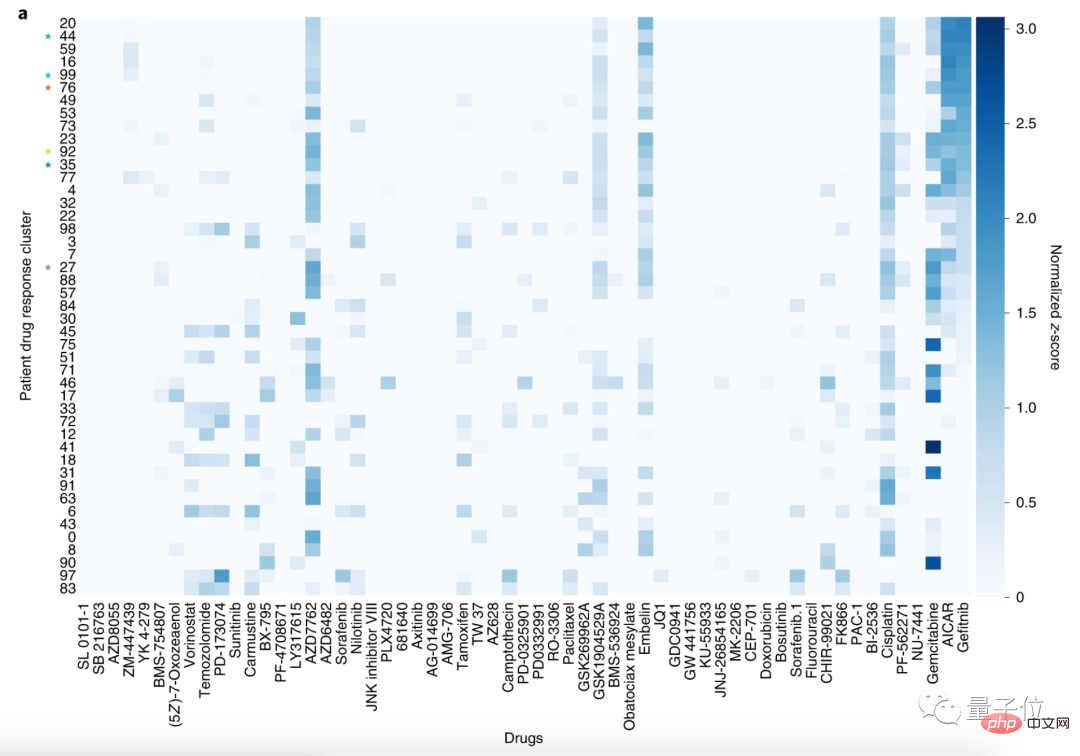
モデルの有効性を実証するために、研究者らは9,808人のがん患者の薬剤適合性を予測した。
患者の状態のモデルによって予測された部位の結果が、患者が使用する薬剤標的に関連している場合、予測が正しいことが証明されます。
研究者らはその後、患者を 100 のクラスターに分け、59 種類の薬剤を 30 のクラスターに分けました。
この分析方法により、同様の薬物反応プロファイルを持つ患者をグループ化できます。
ここでは、肺扁平上皮癌 (LSCC) と非小細胞肺癌 (NSCLC) の患者のクラスター化を例に挙げます。
59 の薬剤の中で、LSCC に対して最も感受性の高い薬剤は、ゲフィチニブ、AICAR、ゲムシタビンです。
ゲフィチニブとAICARの標的はどちらも上皮成長因子受容体(EGFR)であり、ゲムシタビンはEGFR変異のない非小細胞肺がんの治療によく使用されます。
論文では、これらの薬剤の作用機序と一致して、ゲフィチニブとAICARを使用した患者は同様の薬剤反応プロファイルを有することがCODE-AEで判明したと述べられています。
言い換えれば、CODE-AE は患者治療の正しいターゲットを発見しました。つまり、適用可能な薬剤を予測できます。
上記の研究チームはニューヨーク市立大学の出身です。
責任著者は、中国科学技術大学で高分子物理学を卒業したLei Xie氏です。
彼はラトガース大学でコンピュータ サイエンスの修士号を取得して卒業し、博士号もラトガース大学で取得しましたが、化学の学位を取得しました。

研究チームの次のステップは、新薬の臨床反応の濃度と代謝に関する CODE-AE の予測機能を開発することであると理解されています。
研究者らは、AI モデルは人体に対する薬の副作用を予測するためにも応用できる可能性があると述べています。
Nature のサブジャーナル「Nature Machine Intelligence」は、人工知能と生命科学の学際的な応用研究に特化しており、毎年平均掲載論文数が約 60 件であることは注目に値します。
論文アドレス: https://www.nature.com/articles/s42256-022-00541-0
参考リンク: https://phys.org/news/2022-10 -ai-accurately-human-response-drug.html
以上が中国のチームががん患者に適した薬剤を予測するAIの開発に成功し、その結果がネイチャーサブジャーナルに掲載された。の詳細内容です。詳細については、PHP 中国語 Web サイトの他の関連記事を参照してください。

