 Périphériques technologiques
Périphériques technologiques IA
IA 1200 fois plus rapide ! Le MIT développe une nouvelle génération d'IA pour la recherche et le développement de médicaments pour vaincre l'ancien modèle
1200 fois plus rapide ! Le MIT développe une nouvelle génération d'IA pour la recherche et le développement de médicaments pour vaincre l'ancien modèleComme nous le savons tous, l’univers entier est rempli d’innombrables molécules.
Combien de ces molécules ont des propriétés potentiellement médicamenteuses et peuvent être utilisées pour développer des médicaments qui sauvent des vies ? Est-ce un million ? Ou des milliards ? Ou des milliards ?
La réponse est : 10 à la puissance 60.
Un nombre aussi énorme a considérablement retardé les progrès de la recherche et du développement de nouveaux médicaments. Pour les maladies à propagation rapide telles que le COVID-19, il n'existe actuellement aucun médicament spécifique. Cela est également dû au fait que les types et les quantités de molécules sont trop grandes. au-delà de ce que les modèles de conception de médicaments existants peuvent offrir. La plage de calcul.
Une équipe de recherche du MIT ne croit pas à ce mal. Cela ne fonctionne pas, n'est-ce pas ? Alors c'est bien d'accélérer le modèle précédent, n'est-ce pas ?
Cette accélération est 1200 fois.
Ils ont étudié un modèle géométrique d'apprentissage profond appelé « EquiBind », qui est 1 200 fois plus rapide que le précédent modèle d'amarrage moléculaire informatique le plus rapide « QuickVina2-W », et a combiné avec succès des molécules de type médicament avec des protéines, réduisant ainsi les risques et les coûts. échec des essais de médicaments.
Le document de recherche sera publié à l'ICML 2022.
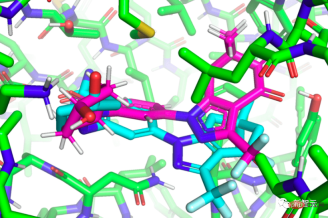
Première introduction à "EquiBind"
"EquiBind" est développé sur la base de son prédécesseur "EquiDock". "EquiDock" utilise la technologie développée par le regretté chercheur en IA du MIT Octavian-Eugen Ganea pour combiner les deux types de protéines. Ganea est également co-auteur de l'article « EquiBind ».
Avant que le développement de médicaments puisse commencer, les chercheurs doivent trouver des molécules prometteuses de type médicament qui peuvent se lier correctement ou « s'arrimer » à des cibles protéiques spécifiques au cours du processus de découverte de médicaments.
Après un amarrage réussi avec la protéine, la combinaison du médicament (ligand) peut empêcher la protéine de fonctionner. Si cela arrive à l’une des protéines essentielles de la bactérie, cela peut tuer la bactérie et ainsi protéger l’organisme.
Cependant, le processus de découverte de médicaments peut être coûteux, tant d'un point de vue économique que informatique. Le processus de R&D coûte souvent des milliards de dollars et peut prendre plus de dix ans de développement avant l'approbation et les tests finaux de la FDA.
Plus important encore, 90 % des médicaments échouent après des essais sur des humains parce qu'ils n'ont aucun effet ou ont trop d'effets secondaires.
Ainsi, l’un des moyens par lesquels les sociétés pharmaceutiques peuvent récupérer ces coûts est d’augmenter le prix du médicament qu’elles développent avec succès.
Entrez dans « EquiBind »
Actuellement, le processus informatique permettant de trouver des molécules candidates prometteuses est le suivant : la plupart des modèles informatiques les plus avancés s'appuient sur un grand nombre d'échantillons candidats, couplés à une notation, un classement, une analyse fine. réglage, etc. méthode pour obtenir la meilleure « correspondance » entre le ligand et la protéine.
Hannes Stärk, étudiant de première année au département de génie électrique et d'informatique du MIT et auteur principal de cet article, a comparé la méthode typique de liaison « ligand-protéine » à « essayer de mettre une clé dans un trou de serrure ». "Fermé".

Les modèles typiques passent du temps à noter chaque « ajustement » avant de sélectionner le meilleur modèle. En revanche, « EquiBind » ne nécessite pas de connaissance préalable de la poche cible de la protéine et peut prédire directement la position clé précise en une seule étape. C'est ce qu'on appelle « l'amarrage aveugle ».
Contrairement à la plupart des modèles qui nécessitent plusieurs tentatives pour trouver la position favorable d'un ligand dans une protéine, "EquiBind" possède déjà des capacités de raisonnement géométrique intégrées qui aident le modèle à apprendre les propriétés physiques sous-jacentes de la molécule et à généraliser avec succès. réussir à généraliser pour faire de meilleures prédictions lorsque vous rencontrez des données nouvelles ou méconnaissables.
La publication de ces résultats a rapidement attiré l'attention des professionnels de l'industrie, notamment Pat Walters, directeur des données de Relay Therapeutics.
Walters a suggéré que l'équipe de recherche pourrait essayer son modèle sur un médicament et une protéine existants utilisés dans le cancer du poumon, la leucémie et les tumeurs gastro-intestinales. Bien que la plupart des méthodes d'amarrage traditionnelles ne parviennent pas à lier avec succès les ligands sur ces protéines, EquiBind réussit.
Walters a déclaré : « EquiBind fournit une solution unique au problème d'amarrage en combinant la prédiction de pose et l'identification du site de liaison. »
« Et cette approche exploite les informations provenant de milliers de structures cristallines publiées. » Nous avons été surpris qu'EquiBind ait pu la mettre en place. dans la bonne poche alors que tout le reste était complètement faux ou qu'un seul avait raison », a déclaré Stärk. Nous sommes très enthousiasmés par ce résultat ! professionnels, et ces commentaires ont aidé l'équipe à envisager l'utilisation pratique du modèle de calcul, Stärk espère toujours trouver une perspective différente lors de la prochaine ICML en juillet.
Stärk a déclaré : "Les commentaires que j'attends le plus avec impatience sont des suggestions sur la manière d'améliorer encore le modèle
.""J'aimerais discuter avec ces chercheurs, leur dire ce que je pense que les prochaines étapes peuvent être et les encourager à aller de l'avant et à utiliser le modèle dans leurs propres articles et méthodes. De nombreux chercheurs nous ont déjà contactés pour nous demander Ce modèle sera-t-il utile pour résoudre leur problème ?
De plus, cet article est également à la mémoire d'Octavian-Eugen Gane, qui a apporté des contributions cruciales à la recherche sur l'apprentissage automatique géométrique et a généreusement encadré de nombreux étudiants. Il était un érudit exceptionnel avec une âme humble. .
Au premier semestre de cette année, il nous a quitté pour toujours lors d'une randonnée.
Ce qui précède est le contenu détaillé de. pour plus d'informations, suivez d'autres articles connexes sur le site Web de PHP en chinois!
 Gemma Scope: le microscope de Google pour regarder dans le processus de pensée de l'IAApr 17, 2025 am 11:55 AM
Gemma Scope: le microscope de Google pour regarder dans le processus de pensée de l'IAApr 17, 2025 am 11:55 AMExplorer le fonctionnement interne des modèles de langue avec Gemma Scope Comprendre les complexités des modèles de langue IA est un défi important. La sortie de Google de Gemma Scope, une boîte à outils complète, offre aux chercheurs un moyen puissant de plonger
 Qui est un analyste de Business Intelligence et comment en devenir un?Apr 17, 2025 am 11:44 AM
Qui est un analyste de Business Intelligence et comment en devenir un?Apr 17, 2025 am 11:44 AMDéverrouiller le succès de l'entreprise: un guide pour devenir un analyste de Business Intelligence Imaginez transformer les données brutes en informations exploitables qui stimulent la croissance organisationnelle. C'est le pouvoir d'un analyste de Business Intelligence (BI) - un rôle crucial dans GU
 Comment ajouter une colonne dans SQL? - Analytique VidhyaApr 17, 2025 am 11:43 AM
Comment ajouter une colonne dans SQL? - Analytique VidhyaApr 17, 2025 am 11:43 AMInstruction ALTER TABLE de SQL: Ajout de colonnes dynamiquement à votre base de données Dans la gestion des données, l'adaptabilité de SQL est cruciale. Besoin d'ajuster votre structure de base de données à la volée? L'énoncé de la table alter est votre solution. Ce guide détaille l'ajout de Colu
 Analyste d'entreprise vs analyste de donnéesApr 17, 2025 am 11:38 AM
Analyste d'entreprise vs analyste de donnéesApr 17, 2025 am 11:38 AMIntroduction Imaginez un bureau animé où deux professionnels collaborent sur un projet critique. L'analyste commercial se concentre sur les objectifs de l'entreprise, l'identification des domaines d'amélioration et la garantie d'alignement stratégique sur les tendances du marché. Simulé
 Que sont le comte et le coude à Excel? - Analytique VidhyaApr 17, 2025 am 11:34 AM
Que sont le comte et le coude à Excel? - Analytique VidhyaApr 17, 2025 am 11:34 AMExcel Counting and Analysis: Explication détaillée du nombre et des fonctions de compte Le comptage et l'analyse des données précises sont essentiels dans Excel, en particulier lorsque vous travaillez avec de grands ensembles de données. Excel fournit une variété de fonctions pour y parvenir, les fonctions Count et Count sont des outils clés pour compter le nombre de cellules dans différentes conditions. Bien que les deux fonctions soient utilisées pour compter les cellules, leurs cibles de conception sont ciblées sur différents types de données. Faisons des détails spécifiques du comptage et des fonctions de coude, mettons en évidence leurs caractéristiques et différences uniques et apprenez à les appliquer dans l'analyse des données. Aperçu des points clés Comprendre le nombre et le cou
 Chrome est là avec l'IA: vivre quelque chose de nouveau tous les jours !!Apr 17, 2025 am 11:29 AM
Chrome est là avec l'IA: vivre quelque chose de nouveau tous les jours !!Apr 17, 2025 am 11:29 AMLa révolution de l'IA de Google Chrome: une expérience de navigation personnalisée et efficace L'intelligence artificielle (IA) transforme rapidement notre vie quotidienne, et Google Chrome mène la charge dans l'arène de navigation Web. Cet article explore les exciti
 Côté humain de l'AI: le bien-être et le quadruple de basApr 17, 2025 am 11:28 AM
Côté humain de l'AI: le bien-être et le quadruple de basApr 17, 2025 am 11:28 AMRéinventuation d'impact: le quadruple bas Pendant trop longtemps, la conversation a été dominée par une vision étroite de l’impact de l’IA, principalement axée sur le résultat du profit. Cependant, une approche plus holistique reconnaît l'interconnexion de BU
 5 cas d'utilisation de l'informatique quantique qui change la donne que vous devriez connaîtreApr 17, 2025 am 11:24 AM
5 cas d'utilisation de l'informatique quantique qui change la donne que vous devriez connaîtreApr 17, 2025 am 11:24 AMLes choses évoluent régulièrement vers ce point. L'investissement affluant dans les prestataires de services quantiques et les startups montre que l'industrie comprend son importance. Et un nombre croissant de cas d'utilisation réels émergent pour démontrer sa valeur


Outils d'IA chauds

Undresser.AI Undress
Application basée sur l'IA pour créer des photos de nu réalistes

AI Clothes Remover
Outil d'IA en ligne pour supprimer les vêtements des photos.

Undress AI Tool
Images de déshabillage gratuites

Clothoff.io
Dissolvant de vêtements AI

AI Hentai Generator
Générez AI Hentai gratuitement.

Article chaud

Outils chauds

Version crackée d'EditPlus en chinois
Petite taille, coloration syntaxique, ne prend pas en charge la fonction d'invite de code

Version Mac de WebStorm
Outils de développement JavaScript utiles

Navigateur d'examen sécurisé
Safe Exam Browser est un environnement de navigation sécurisé permettant de passer des examens en ligne en toute sécurité. Ce logiciel transforme n'importe quel ordinateur en poste de travail sécurisé. Il contrôle l'accès à n'importe quel utilitaire et empêche les étudiants d'utiliser des ressources non autorisées.

SublimeText3 version anglaise
Recommandé : version Win, prend en charge les invites de code !

Envoyer Studio 13.0.1
Puissant environnement de développement intégré PHP





