Maison >Périphériques technologiques >IA >Shi Yigong et d'autres équipes font la couverture de Science : l'IA et la microscopie cryoélectronique révèlent la structure des PNJ au « niveau atomique », une percée dans les sciences de la vie
Shi Yigong et d'autres équipes font la couverture de Science : l'IA et la microscopie cryoélectronique révèlent la structure des PNJ au « niveau atomique », une percée dans les sciences de la vie
- WBOYWBOYWBOYWBOYWBOYWBOYWBOYWBOYWBOYWBOYWBOYWBOYWBavant
- 2023-04-11 17:22:031266parcourir
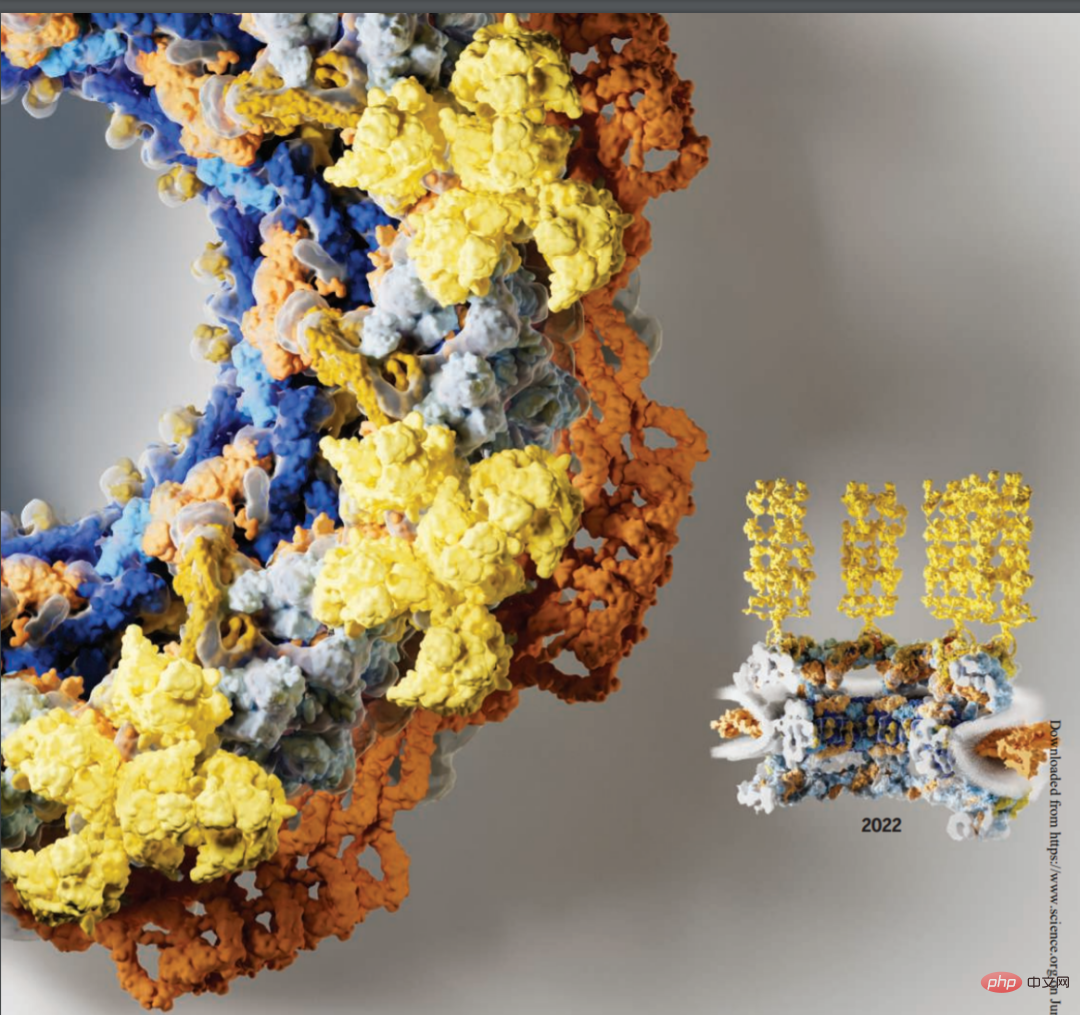
Avant de commencer le texte, jetons un coup d’œil à une image ci-dessous, il est évident que la moitié droite de l’image représente des informations plus riches et une structure plus claire. La moitié gauche de l'image de 2016 a une structure relativement simple et représente moins d'informations :

En fait, ce qui est montré ci-dessus est une image du complexe de pores nucléaires (NPC). Le complexe de pores nucléaires, composé d'environ 1 000 sous-unités protéiques, est responsable du transport intense des macromolécules entre le noyau et le cytoplasme des cellules eucaryotes. Il constitue également le seul canal bidirectionnel reliant le cytoplasme et le noyau. En plus de coordonner le transport, les PNJ organisent des événements essentiels de la vie tels que la transcription, la maturation de l'ARNm, l'assemblage des spliceosomes et des ribosomes. Le rôle puissant du NPC est devenu un élément clé dans la mutation de la maladie et dans les interactions hôte-pathogène.
Grâce au développement de la structure des pores nucléaires complets à basse résolution et de la technologie de structure des composants des pores nucléaires à haute résolution, les pores nucléaires des cellules reçoivent de plus en plus d'attention. Cependant, utiliser ces informations pour assembler correctement plus de 30 copies de protéines différentes et construire des structures tridimensionnelles à haute résolution s’est avéré un défi difficile.
Aujourd'hui, le magazine "Science" a publié 5 articles en couverture, dont 3 ont révélé conjointement la structure de cryo-microscopie électronique à résolution quasi atomique du complexe des pores nucléaires humains, et les deux autres études sur la particule unique de Xenopus laevis. Des images cryo-EM du complexe de pores nucléaires des vertébrés sont présentées. Cet article de couverture rassemble plusieurs études pour créer une image à l’échelle quasi atomique des PNJ humains.

Adresse papier : https://www.science.org/doi/pdf/10.1126/science.add2210
Ce résultat de recherche s'appuie sur plusieurs études, dont plusieurs Dix années de reconstruction biochimique, cristallographie aux rayons X, spectrométrie de masse, mutagenèse et biologie cellulaire, entre autres. Les PNJ humains ont été reconstruits à l’aide d’une cryotomographie électronique grandement améliorée et leurs composants ont été modélisés avec précision à l’aide de techniques d’intelligence artificielle. Il existe d'autres études qui ont amélioré la résolution du cryo-EM à particule unique, permettant la visualisation d'éléments structurels secondaires et de détails au niveau des résidus des PNJ vertébrés. L’assemblage moléculaire enrichit notre compréhension de l’architecture des PNJ vertébrés et humains, de l’ancien échafaudage nucléaire aux connexines qui maintiennent les pièces ensemble, et de l’ancrage de la membrane nucléaire aux filaments cytoplasmiques au-dessus du canal de transport central.
Les résultats de recherche rapportés ici représentent une coopération gagnant-gagnant entre la biologie structurale expérimentale et l'intelligence artificielle, et constituent une autre victoire pour l'humanité dans l'exploration du monde microscopique biologique. En outre, cela démontre également que la révolution en cours dans la résolution est irremplaçable dans notre quête pour comprendre les principes de construction et de conception des assemblages macromoléculaires.
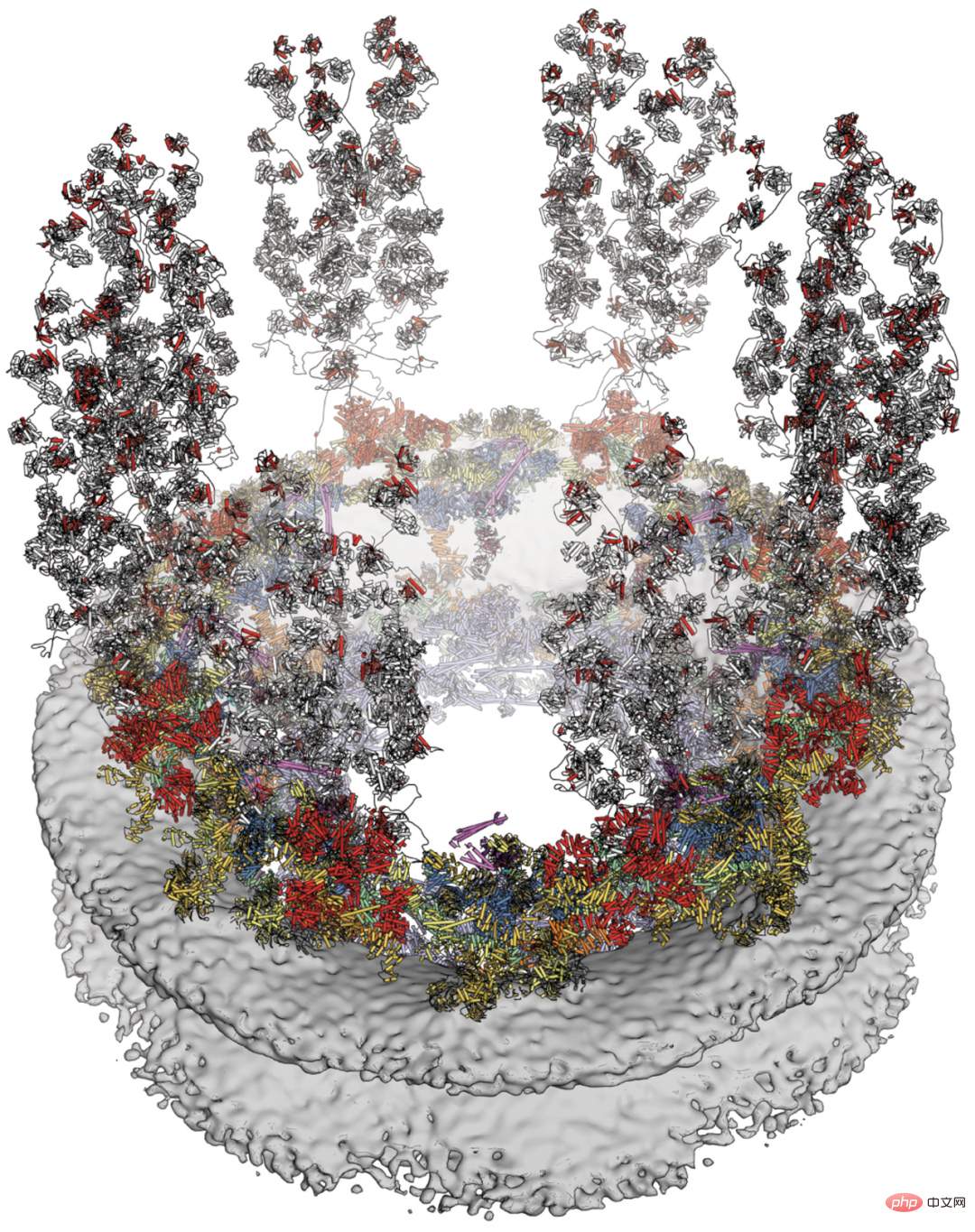
Vous trouverez ci-dessous une vue transversale du complexe des pores nucléaires humains en 2022, avec des composants nouvellement résolus, notamment le noyau symétrique (orange) et les filaments cytoplasmiques (jaune) :
Cinq articles de recherche
Article 1 : "Architecture de la face cytoplasmique du pore nucléaire"

Adresse de l'article : https://www.science.org/doi/10.1126/science.abm9129
Nucléaire Le complexe de pores (NPC) est le seul canal bidirectionnel de transport nucléocytoplasmique. Malgré les progrès récents dans l’élucidation de la structure centrale symétrique du NPC, la surface cytoplasmique asymétriquement distribuée, qui constitue un point chaud pour l’exportation d’ARNm et les maladies liées aux nucléoporines, reste insaisissable.
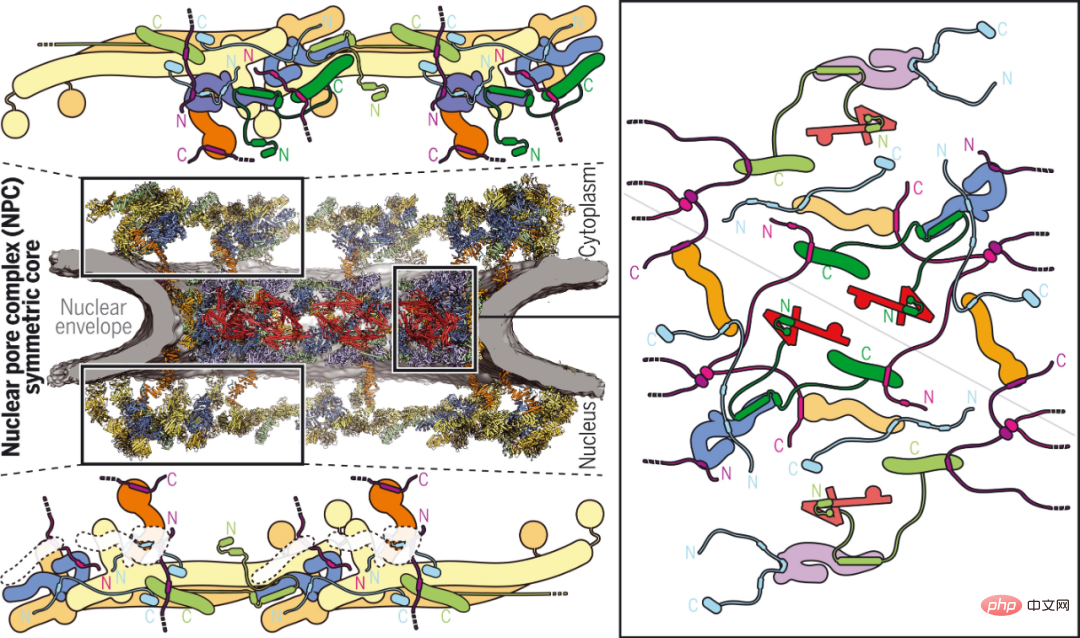
Des chercheurs du California Institute of Technology et d'autres institutions rapportent la structure composite de la surface cytoplasmique humaine obtenue en combinant la reconstruction biochimique, la détermination de la structure cristalline, la reconstruction par cryo-tomographie électronique et la vérification physiologique. Alors que des motifs spécifiques à l'espèce ancrent un complexe de nucléoporine de filament cytoplasmique hétérohexamère d'environ 540 kilodaltons conservé au cours de l'évolution au-dessus du canal de transport central, la fixation du faisceau pentamère NUP358 dépend de l'arrangement bicyclique dans le complexe de nucléoporine de l'enveloppe. Les structures complexes qu’elles révèlent et leur pouvoir prédictif constituent une base riche pour élucider les bases moléculaires de l’exportation d’ARNm et des maladies liées aux nucléoporines.
Visage cytoplasmique de PNJ humain.
Article 2 : "Architecture de l'échafaudage de liaison dans le pore nucléaire"

Adresse de l'article : https://www.science.org/doi/10.1126/science .abm9798
Bien que l'on ait pu déterminer l'arrangement des nucléoporines d'échafaudage structurées dans le noyau symétrique des PNJ, leur cohésion via des nucléoporines de liaison multivalentes non structurées reste insaisissable.
En combinant la reconstruction biochimique, la détermination de structure à haute résolution, la reconstruction par cryo-tomographie électronique et la validation physiologique, les chercheurs de Caltech élucident la structure d'échafaudage de liaison conservée au cours de l'évolution qui génère environ 64 mégadals de NPC humains. Un noyau de structure composite quasi atomique avec symétrie du mégadalton. Alors que les articulations jouent généralement un rôle rigide, l'échafaudage commun du NPC fournit la plasticité et la robustesse nécessaires à la contraction et à l'expansion réversibles de ses canaux de transport centraux et à l'émergence de canaux latéraux. Leurs résultats font progresser considérablement la caractérisation structurelle du noyau de symétrie NPC et jettent les bases de futures études fonctionnelles.
Structure de support articulaire pour noyau de symétrie PNJ humain.
Article 3 : "La prédiction de structure basée sur l'IA permet une analyse intégrative des pores nucléaires humains"

Adresse de l'article : https://www.science.org/doi / 10.1126/science.abm9506
Bien que les complexes de pores nucléaires (NPC) assurent le transport nucléocytoplasmique, leur architecture complexe de 120 mégadaltons reste incomplètement comprise. Des chercheurs de l'Institut Max Planck de biophysique et d'autres ont rapporté un modèle de 70 mégadaltons d'un échafaudage de PNJ humain avec des membranes explicites et de multiples états conformationnels.
Ils combinent des prédictions structurelles basées sur l'IA avec une cryo-tomographie électronique in situ et cellulaire, une modélisation complète. Les résultats montrent que les nucléoporines adaptatrices organisent des échafaudages au sein et entre les sous-complexes pour construire des structures d’ordre supérieur. Des simulations de dynamique moléculaire d’une microseconde montrent que l’échafaudage n’a pas besoin de stabiliser la fusion des membranes nucléaires interne et externe, mais élargit plutôt le pore central. Ils illustrent comment la modélisation basée sur l’IA peut être combinée à la biologie structurale in situ pour comprendre les structures subcellulaires à différents niveaux d’organisation spatiale.
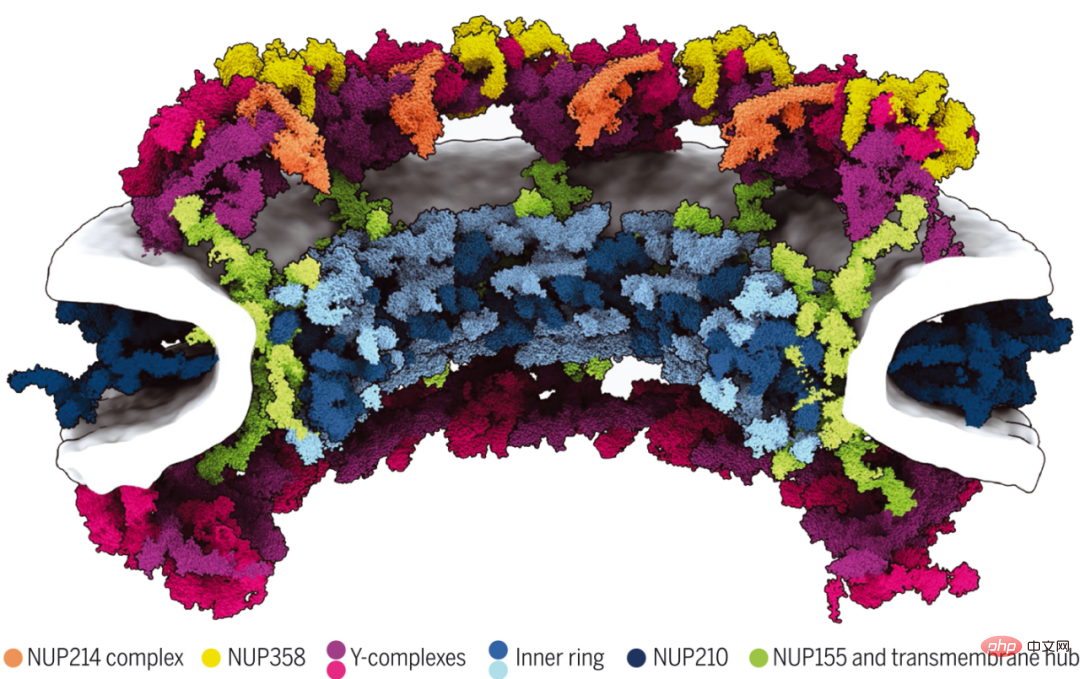
Modèle de 70 mégadaltons de l'architecture d'échafaudage des PNJ humains.
Fascicule 4 : "Structure de l'anneau cytoplasmique du complexe de pores nucléaires de Xenopus laevis"

Adresse papier : https://www.science.org/doi/10.1126/science.abl8280
L'Université de Westlake et l'Université de Tsinghua ont analysé le PNJ Xenopus laevis à une résolution de 3,7 à 4,7 Angströms (angstrom) Single -reconstruction par cryo-microscopie électronique de particules de la sous-unité de l'anneau cytoplasmique. Parmi ceux-ci, la structure du domaine amino-terminal de Nup358 a été résolue à 3,0 Å, ce qui a facilité l'identification de cinq molécules Nup358 dans chaque sous-unité de l'anneau cytoplasmique.
Le modèle final des chercheurs de la sous-unité de l'anneau cytoplasmique comprend cinq molécules Nup358, deux Nup205 et deux Nup93, ainsi que deux complexes Y précédemment caractérisés. Le fragment carboxy-terminal de Nup160 sert de centre organisateur pour le sommet de chaque complexe Y. L'analyse structurelle révèle comment Nup93, Nup205 et Nup358 favorisent et améliorent l'assemblage d'un échafaudage d'anneaux cytoplasmiques formé principalement de deux couches de complexes Y.
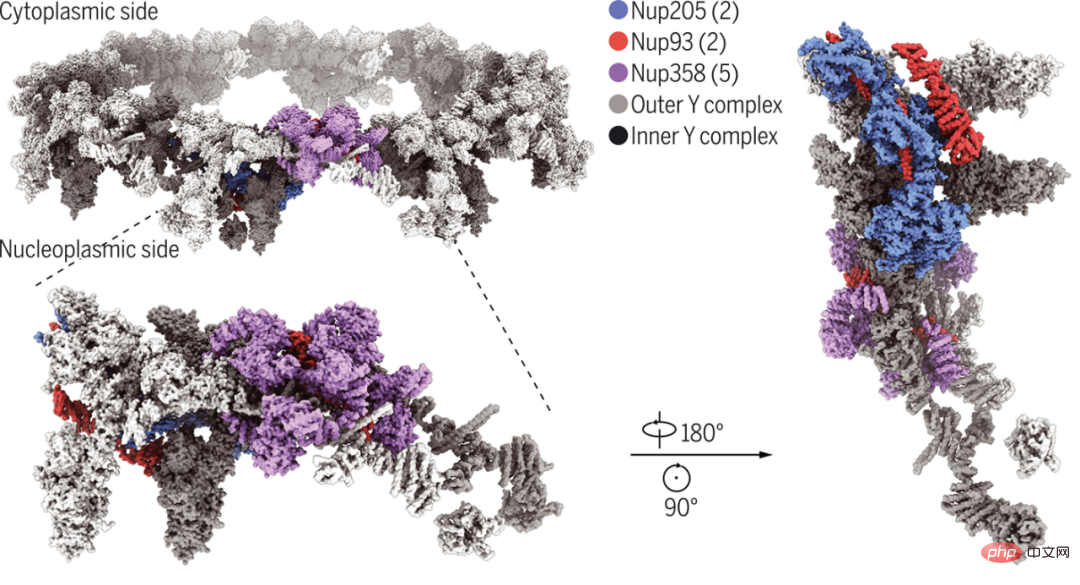
Structure Cryo-EM de l'anneau cytoplasmique bicouche Xenopus laevis NPC.
Papier 5 : "Structure de l'anneau cytoplasmique du complexe de pores nucléaires par cryo-EM intégratif et AlphaFold"

Adresse du papier : https://www.science.org /doi/10.1126/science.abm9326
Des chercheurs de la Harvard Medical School et d'autres institutions ont utilisé la microscopie cryoélectronique à particule unique et la prédiction AlphaFold pour déterminer une structure d'anneau cytoplasmique NPC presque complète à partir d'ovocytes de Xenopus laevis. Plus précisément, ils ont utilisé AlphaFold pour prédire la structure des nucléoporines et ajuster la carte à moyenne résolution en utilisant comme guide la densité de structure secondaire importante.
De plus, certaines interactions moléculaires ont été établies ou confirmées grâce à des prédictions complexes utilisant AlphaFold. Les chercheurs ont identifié cinq modes de liaison pour Nup358, la plus grande sous-unité NPC avec des répétitions Phe-Gly pour le transport. Ils ont prédit que Nup358 contiendrait un domaine en spirale qui fournirait une activité lui permettant de servir de centre de nucléation pour la formation de NPC dans certaines conditions.
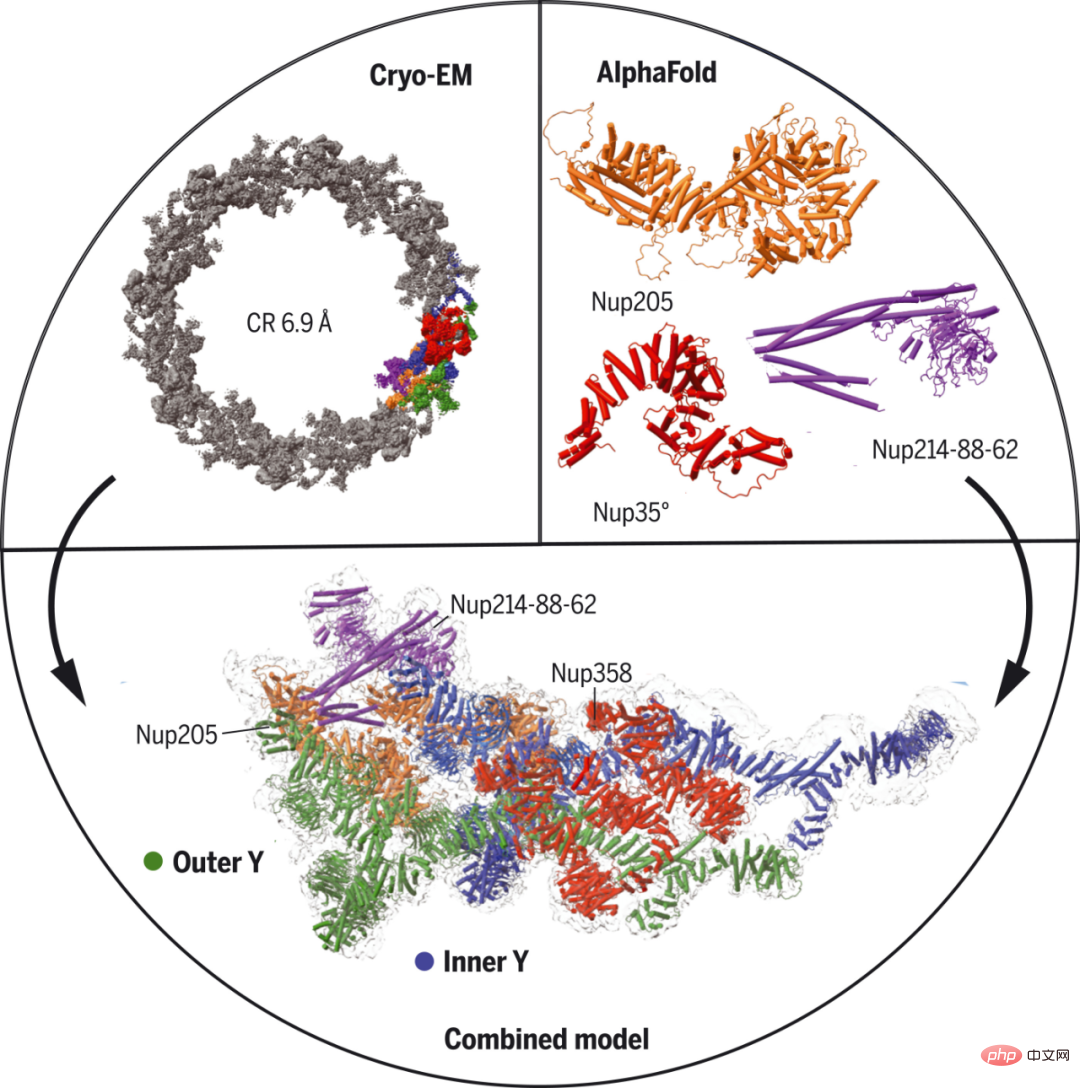
Structure Cryo-EM de l'anneau cytoplasmique Xenopus NPC.
Ce qui précède est le contenu détaillé de. pour plus d'informations, suivez d'autres articles connexes sur le site Web de PHP en chinois!
Articles Liés
Voir plus- Tendances technologiques à surveiller en 2023
- Comment l'intelligence artificielle apporte un nouveau travail quotidien aux équipes des centres de données
- L'intelligence artificielle ou l'automatisation peuvent-elles résoudre le problème de la faible efficacité énergétique des bâtiments ?
- Co-fondateur d'OpenAI interviewé par Huang Renxun : les capacités de raisonnement de GPT-4 n'ont pas encore atteint les attentes
- Bing de Microsoft surpasse Google en termes de trafic de recherche grâce à la technologie OpenAI

