Maison >Périphériques technologiques >IA >Efficacité augmentée de 1200 fois ! Le MIT développe un nouveau modèle pharmaceutique d'IA
Efficacité augmentée de 1200 fois ! Le MIT développe un nouveau modèle pharmaceutique d'IA
- 王林avant
- 2023-04-09 18:31:011427parcourir
Selon le média étranger Tech Xplore, des chercheurs du MIT ont récemment développé un nouveau modèle appelé EquBind, qui peut prédire à l'avance la structure de nouvelles molécules protéiques et améliorer l'efficacité du développement de médicaments.
À l'heure actuelle, cette technologie est reconnue par l'industrie, et les articles décrivant cette technologie seront également acceptés par la Conférence internationale sur l'apprentissage automatique (ICML) en juillet.
1. La vitesse est augmentée de 1 200 fois et le modèle EquBind peut rapidement cribler des molécules ressemblant à des médicaments
Actuellement, la recherche et le développement de médicaments sont un processus long et coûteux. La principale raison est que le développement de médicaments coûte très cher. Ce coût comprend non seulement des milliards de dollars d’investissement en capital, mais également des décennies de recherche.
Et pendant le processus de recherche et développement, 90 % des médicaments échoueront en raison de leur inefficacité ou d'un trop grand nombre d'effets secondaires. Seuls 10 % des médicaments peuvent passer avec succès l'inspection de la Food and Drug Administration et être approuvés pour la commercialisation.
Par conséquent, les sociétés pharmaceutiques augmenteront les prix des médicaments développés avec succès pour compenser les pertes causées par les médicaments ayant échoué, de sorte que les prix de certains médicaments restent actuellement élevés.
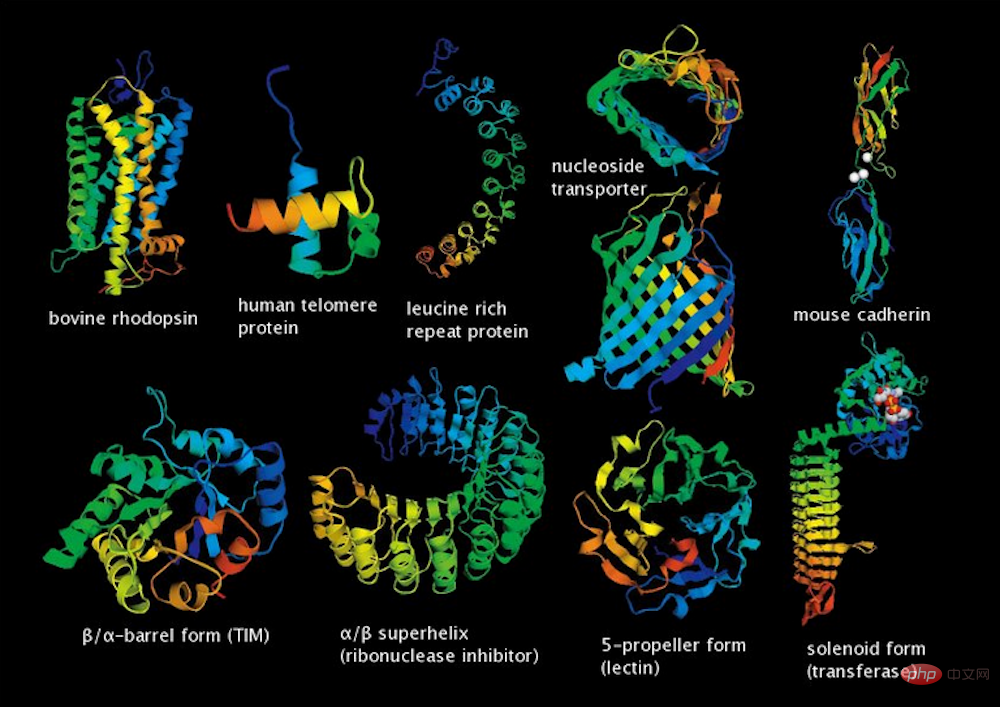
▲Certaines structures moléculaires protéiques
Si les chercheurs veulent développer des médicaments, ils doivent d'abord trouver des molécules de type médicament ayant un potentiel de développement. Une autre raison importante expliquant la lenteur des progrès dans le développement de médicaments est le grand nombre de molécules de type médicament existantes. Les données montrent qu’il existe actuellement jusqu’à 1 016 molécules de type médicament, un nombre qui dépasse de loin la limite supérieure de calcul des modèles de calcul moléculaire existants.
Afin de traiter des molécules avec des données aussi énormes et d'accélérer le processus de développement de médicaments, Hannes St rk, un étudiant diplômé de première année au Département de génie électrique et d'informatique du MIT, a développé un modèle géométrique d'apprentissage profond appelé " EquBind". EquBind fonctionne 1 200 fois plus rapidement que les modèles d’amarrage informatiques moléculaires existants les plus rapides, ce qui lui permet de trouver plus rapidement des molécules de type médicament.
2. Le modèle EquBind peut prédire avec précision les structures des protéines et améliorer l'efficacité du développement de médicaments.
Actuellement, la plupart des modèles d'amarrage informatiques moléculaires traditionnels sont trouvés grâce à une méthode appelée « liaison du ligand à la protéine » pour les molécules de type médicament. Plus précisément, le modèle doit d'abord recevoir un grand nombre de molécules d'échantillon, puis laisser les ligands se lier à diverses molécules, puis le modèle note différentes molécules, puis utilise le classement final pour sélectionner les molécules les plus appropriées. Cependant, cette approche comporte un processus compliqué et le modèle est moins efficace pour trouver des molécules ressemblant à des médicaments.
Hannes St rk a fait une métaphore vivante pour ce processus. Il a déclaré : « L'approche typique précédente « ligand-protéine » revenait à essayer de faire en sorte que le modèle insère la clé dans une serrure comportant de nombreux trous de serrure. " Utilisez le temps pour marquer l'ajustement entre la clé et chaque trou de serrure, puis sélectionnez celle qui convient le mieux. " Il a poursuivi en expliquant : " Et EquBind peut sauter les étapes les plus longues lors de la rencontre de nouvelles molécules ". Le trou de serrure à l'avance est appelé « amarrage aveugle ». EquBind dispose d'un algorithme de raisonnement géométrique intégré qui peut aider le modèle à apprendre la structure de base de la molécule. Cet algorithme permet à EquBind d'en rencontrer de nouvelles. La position la plus appropriée peut être directement prédite. au moment de la molécule, sans passer beaucoup de temps à essayer différentes positions et à noter. »
 ▲MIT
▲MIT
3 Le modèle EquBind a été utilisé avec succès dans l'industrie, et l'auteur attend avec impatience d'en savoir plus.
Ce modèle a attiré l'attention de Pat Walters, Chief Data Officer de la société thérapeutique Relay. Walster a suggéré que le groupe de recherche de Hannes Störk utilise ce modèle pour développer des médicaments contre le cancer du poumon, la leucémie et les tumeurs gastro-intestinales. D'une manière générale, les ligands protéiques utilisés dans les médicaments dans ces domaines sont difficiles à ancrer à l'aide de la plupart des méthodes traditionnelles, mais EquBind peut les ancrer avec succès.
 ▲Deux médicaments inhibiteurs pour le traitement du cancer du poumon
▲Deux médicaments inhibiteurs pour le traitement du cancer du poumon
Walters a déclaré : « EquBind fournit une solution unique au problème d'amarrage des protéines, qui résout les problèmes de prédiction de la structure et d'identification du site de liaison. En utilisant des milliers d'informations sur la structure cristalline accessibles au public, EquBind pourrait avoir un impact nouveau sur le domaine. "
Un article publiant cette technologie sera accepté par la Conférence internationale sur l'apprentissage automatique (ICML) en juillet. Hannes St rk, l'auteur de le journal, a déclaré : « J'attends avec impatience de recevoir quelques suggestions pour améliorer le modèle EquBind lors de cette conférence. »
Conclusion : l'IA a une excellente compatibilité avec les produits pharmaceutiques et sa dynamique de développement est en plein essor.
AI Pharmaceuticals est un domaine émergent qui n’est apparu au public qu’en 2020.
Le domaine pharmaceutique est un scénario naturel d’IA. Le cycle long, le coût élevé et le faible taux de réussite de la recherche et du développement de nouveaux médicaments ont laissé une place immense à l'utilisation de l'IA : les machines peuvent apprendre et exploiter des données de manière autonome, résumer les règles de recherche et de développement de médicaments au-delà de l'expérience des experts, puis optimiser. le processus de recherche et de développement de médicaments. À tous égards, cela peut non seulement améliorer l'efficacité et le taux de réussite de la recherche et du développement de médicaments, mais devrait également réduire les dépenses de recherche et de développement et les coûts d'essais et d'erreurs.
En raison de ces caractéristiques et de leur potentiel de développement, les produits pharmaceutiques basés sur l’IA prennent actuellement de l’ampleur. Cependant, certains acteurs de l'industrie sont pessimistes, affirmant que l'IA ne joue qu'un rôle de soutien dans le processus pharmaceutique et ne peut pas contourner les processus et mécanismes inhérents à l'industrie. Il est impossible de terminer dix ans de travail en deux ou trois ans.
Mais dans l’ensemble, il y a encore de nouvelles avancées technologiques dans le domaine des produits pharmaceutiques IA, et le développement est en plein essor.
Ce qui précède est le contenu détaillé de. pour plus d'informations, suivez d'autres articles connexes sur le site Web de PHP en chinois!
Articles Liés
Voir plus- Tendances technologiques à surveiller en 2023
- Comment l'intelligence artificielle apporte un nouveau travail quotidien aux équipes des centres de données
- L'intelligence artificielle ou l'automatisation peuvent-elles résoudre le problème de la faible efficacité énergétique des bâtiments ?
- Co-fondateur d'OpenAI interviewé par Huang Renxun : les capacités de raisonnement de GPT-4 n'ont pas encore atteint les attentes
- Bing de Microsoft surpasse Google en termes de trafic de recherche grâce à la technologie OpenAI

