Maison >Périphériques technologiques >IA >Connectez-vous à Science, l'affinité des médicaments a été multipliée par 37, l'IA effectue une optimisation non supervisée des complexes de protéines et d'anticorps
Connectez-vous à Science, l'affinité des médicaments a été multipliée par 37, l'IA effectue une optimisation non supervisée des complexes de protéines et d'anticorps
- 王林original
- 2024-07-18 22:22:51793parcourir

Les protéines sont impliquées dans de nombreuses fonctions biologiques telles que la composition cellulaire, la contraction musculaire, la digestion des aliments et l'identification des virus.
Afin de concevoir de meilleures protéines (y compris des anticorps), les scientifiques font souvent muter à plusieurs reprises les acides aminés (en organisant les unités qui composent les protéines dans un certain ordre) à différentes positions jusqu'à ce que la protéine obtienne la fonction requise.
Mais il y a plus de séquences d’acides aminés qu’il n’y a de grains de sable dans le monde, donc trouver la meilleure protéine, et donc le meilleur médicament potentiel, est souvent difficile. Face à ce défi, les scientifiques dépensent souvent des millions de dollars et testent des versions miniaturisées et simplifiées de systèmes biologiques.
« Cela nécessite beaucoup de conjectures et de vérifications. » Brian L. Hie, professeur adjoint de génie chimique à l'Université de Stanford et chercheur en innovation à l'Arc Institute, a déclaré : « L'objectif de nombreux algorithmes intelligents est d'éliminer les conjectures. "
Les scientifiques de l'Université de Stanford ont développé une nouvelle méthode basée sur l'apprentissage automatique qui peut prédire plus rapidement et avec plus de précision les changements moléculaires conduisant à de meilleurs anticorps. En combinant la structure 3D du squelette protéique avec un grand modèle de langage basé sur la séquence d’acides aminés, les chercheurs ont pu trouver des mutations rares et souhaitables en quelques minutes.
L'étude s'intitulait « Evolution non supervisée des complexes de protéines et d'anticorps avec un modèle de langage informé par la structure » et a été publiée dans « Science » le 4 juillet 2024.

Les grands modèles de langage formés uniquement sur les informations de séquence peuvent apprendre les principes de haut niveau de la conception des protéines. Cependant, outre la séquence, la structure tridimensionnelle des protéines détermine leur fonction, leur activité et leur évolutivité spécifiques.
Pour les problèmes d'ingénierie des anticorps, des chercheurs de l'Université de Stanford ont appliqué des modèles de langage protéique structurellement informés pour prédire des séquences de haute condition physique contraintes par des structures complexes d'anticorps ou d'anticorps-antigène connues.
La recherche montre qu'un modèle universel de langage protéique augmenté de coordonnées du squelette structurel des protéines peut guider l'évolution de différentes protéines sans qu'il soit nécessaire de modéliser des tâches fonctionnelles individuelles.
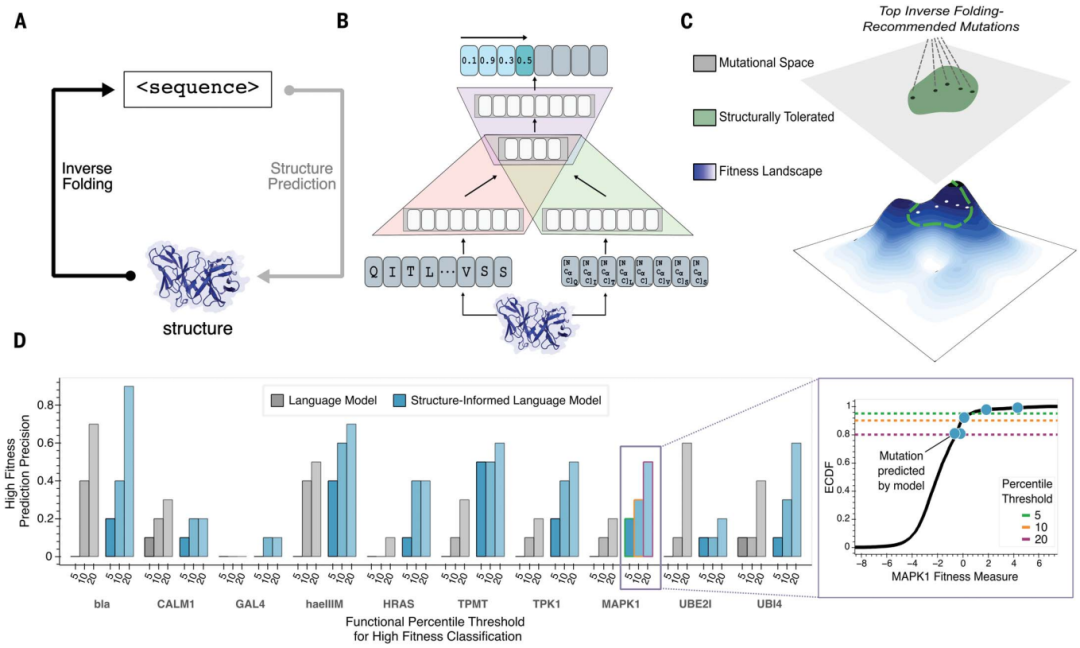
-
Paradigme guidé par la structure :
- ne modélise pas une définition explicite de la fonction ou de la forme physique des protéines.
- Concentrez-vous sur les régions qui conservent le repliement du squelette protéique et explorez indirectement le paysage du fitness.
- Supposons que l'évolution dans une plage de probabilité de séquence élevée soit un a priori valable pour les variantes à haute condition physique.
-
Large application :
- peut étudier indirectement le paysage de la condition physique des protéines dans différents environnements, tels que la catalyse enzymatique, la résistance aux antibiotiques et la résistance à la chimiothérapie.
-
Conception de complexes protéiques :
- ESM-IF1 formé uniquement sur des structures à chaîne unique peut être étendu pour concevoir des complexes protéiques.
- Montre que les modèles de langage d'information structurelle peuvent implicitement apprendre à combiner des fonctionnalités et à généraliser aux polyprotéines.
-
Évolution des anticorps humains :
- Cette méthode est particulièrement utile pour l'évolution des anticorps humains et peut être utilisée pour traiter diverses maladies.
- Les anticorps offrent une protection en se liant aux antigènes cibles.
-
Remplacer de grandes quantités de données :
- Les structures peuvent remplacer de grandes quantités de données et l'ordinateur peut toujours apprendre.
- Plus d'anticorps ont des opportunités d'optimisation.
-
Évolution dirigée :
- Cette méthode est utilisée pour guider expérimentalement les activités d'évolution dirigée de plusieurs protéines.
- Générez des conceptions avec une activité fonctionnelle supérieure aux protéines de type sauvage.
- Pas besoin d'analyser les données de condition physique étiquetées ou de superviser un modèle spécifique à une tâche.
Illustration : L'évolution des anticorps à l'aide de modèles de langage d'information structurels peut améliorer le pouvoir neutralisant et la résilience. (Source : article)
Avec cette méthode, l'équipe a sélectionné environ 30 candidats pour deux anticorps cliniques thérapeutiques pour le traitement des variantes du coronavirus 2 (SRAS-CoV-2) du syndrome respiratoire aigu sévère. Dans le même temps, les chercheurs ont obtenu une neutralisation multipliée par 25 et une affinité multipliée par 37 contre les variantes du virus d’évasion d’anticorps BQ.1.1 et XBB.1.5, respectivement.
En conclusion, Cet outil aidera à répondre rapidement aux maladies nouvelles ou en développement. Cela réduit également les obstacles à la fabrication de médicaments plus efficaces. Des médicaments plus puissants nécessitent des doses plus faibles, ce qui signifie qu’un plus grand nombre de patients peuvent bénéficier d’une dose donnée.
Lien papier : https://www.science.org/doi/10.1126/science.adk8946
Rapports associés : https://phys.org/news/2024-07-ai-approach-optimizes- anticorps-drogues.html
Ce qui précède est le contenu détaillé de. pour plus d'informations, suivez d'autres articles connexes sur le site Web de PHP en chinois!
Articles Liés
Voir plus- Tendances technologiques à surveiller en 2023
- Comment l'intelligence artificielle apporte un nouveau travail quotidien aux équipes des centres de données
- L'intelligence artificielle ou l'automatisation peuvent-elles résoudre le problème de la faible efficacité énergétique des bâtiments ?
- Co-fondateur d'OpenAI interviewé par Huang Renxun : les capacités de raisonnement de GPT-4 n'ont pas encore atteint les attentes
- Bing de Microsoft surpasse Google en termes de trafic de recherche grâce à la technologie OpenAI

