Heim >Technologie-Peripheriegeräte >KI >KI-Arzneimittelforscher tritt der Unterzeitschrift „Nature' bei: Nutzung von Fachwissen zur Beschleunigung der Arzneimittelentwicklung
KI-Arzneimittelforscher tritt der Unterzeitschrift „Nature' bei: Nutzung von Fachwissen zur Beschleunigung der Arzneimittelentwicklung
- 王林nach vorne
- 2023-11-02 17:45:231219Durchsuche
Die Entdeckung von Arzneimitteln ist ein komplexer, mehrstufiger Prozess, der die Schnittstelle vieler Teildisziplinen der Chemie und Biologie umfasst. Humanmedizinische Chemiker spielen dabei mit ihrer jahrelang gesammelten Expertise eine wichtige Rolle
Kann also künstliche Intelligenz (KI) die Rolle übernehmen, die medizinische Chemiker bei der Arzneimittelentwicklung spielen? Die Antwort könnte ja sein.
Kürzlich hat ein Forschungsteam der Novartis Institutes for Biomedical Research (NIBR) und des Microsoft Research Center for Scientific Intelligence (AI4Science) gemeinsam ein Modell für maschinelles Lernen vorgeschlagen, das das von professionellen Chemikern in ihrer Arbeit gesammelte kollektive Wissen teilweise reproduzieren kann Diese Art von Wissen wird oft als „chemische Intuition“ bezeichnet.
Das Forschungsteam ist davon überzeugt, dass diese Methode als Ergänzung zur molekularen Modellierung eingesetzt werden kann, um die Effizienz der zukünftigen Arzneimittelentwicklung zu verbessern
Die Forschungsarbeit trägt den Titel „Extracting Intuition in Medicinal Chemistry through Preference Machine Learning“ und wurde in Nature Communications, einer Unterzeitschrift von Nature, veröffentlicht

Maschinelles Lernen stellt das Fachwissen von Medizinchemikern wieder her
Medizinische Chemiker, sowohl Nasslabor- als auch Computerchemiker, spielen eine entscheidende Rolle in der Phase der „Leitoptimierung“ der Arzneimittelentwicklung, da sie oft gebeten werden, zu bestimmen, welche Verbindungen synthetisiert und in nachfolgenden Optimierungsrunden evaluiert werden müssen.Zu diesem Zweck überprüfen medizinische Chemiker typischerweise Daten, einschließlich der Eigenschaften von Verbindungen wie Aktivität, ADMET2 oder Informationen zur Zielstruktur. Daher hängt der Erfolg eines Projekts nicht nur von der Qualität der generierten experimentellen Daten ab, sondern auch von der Robustheit und Rationalität der Entscheidungen des in der medizinischen Chemie arbeitenden Teams.
Medizinische Chemiker können Entscheidungen effizienter treffen, da sie häufig auf Fachwissen zurückgreifen, um ein intuitives Verständnis dafür zu entwickeln, was in verschiedenen Iterationen der frühen Arzneimittelforschung gelingt.
Während es bereits frühere Versuche gab, dieses Wissen mithilfe regelbasierter Ansätze oder einfacher chemoinformatischer Machbarkeitsbewertungen zu formalisieren, bleibt die Erfassung der Subtilität und Komplexität der Bewertung durch medizinische Chemiker eine grundlegende HerausforderungUm dieses Ziel zu erreichen, zielt die Forschung darauf ab, Fachwissen in einen Teil eines maschinellen Lernmodells umzuwandeln. Dieses Modell kann wie andere Empfehlungssysteme, über die in der Branche berichtet wurde, als Hilfswerkzeug verwendet werden, um den Entscheidungsprozess bei der Lead-Optimierung oder anderen Aspekten der Arzneimittelentwicklung einzusetzen
Wenn man bedenkt, dass die medizinische Chemie derzeit hauptsächlich auf Handarbeit beruht, ist sie zwangsläufig von subjektiven Voreingenommenheiten betroffen. Einige Studien haben eine geringe Übereinstimmung bei den Bewertungen sowohl zwischen medizinischen Chemikern als auch innerhalb medizinischer Chemiker festgestellt.
In dieser Studie hoffen die Forscher, einige Probleme zu lösen, indem sie Strategien aus Multiplayer-Spielen übernehmen.Sie behandelten die Aufgabe, eine Reihe von Molekülen einzuordnen, als Präferenz-Lernproblem und verwendeten dann ein einfaches neuronales Netzwerk, um individuelle Präferenzen zu modellieren.
Abbildung |. Gesamtschematische Darstellung der Hauptideen der Forschung (Quelle: das Papier)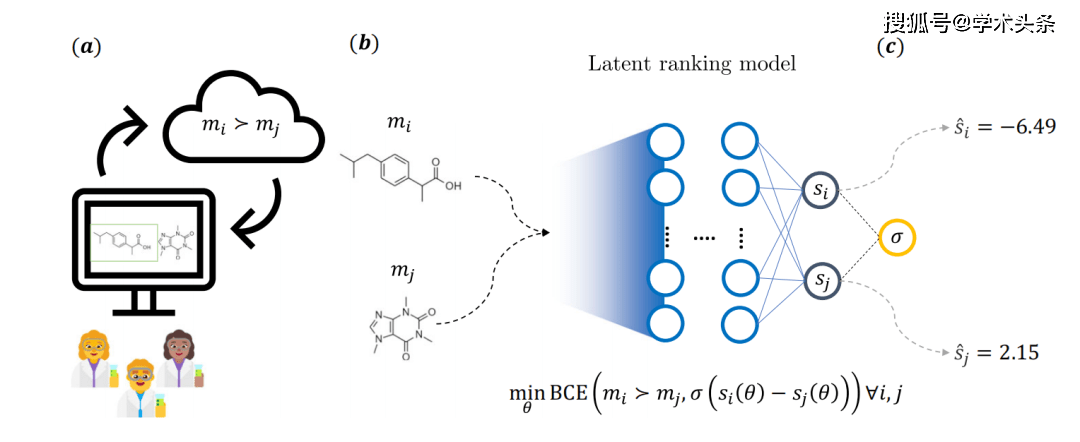 Konkret werden Moleküle, wie in der Abbildung oben dargestellt, als Teilnehmer eines Wettbewerbsspiels betrachtet, wobei die Wahrscheinlichkeit, dass eine Seite gewinnt, durch das Feedback des Chemikers bestimmt wird. Dazu beantworten medizinische Chemiker in einer Webanwendung vorgegebene Fragen und wählen eines von zwei Molekülen aus. Insgesamt waren 35 medizinische Chemiker von Novartis an dem Prozess beteiligt, der zur Sammlung von mehr als 5.000 Anmerkungen führte.
Konkret werden Moleküle, wie in der Abbildung oben dargestellt, als Teilnehmer eines Wettbewerbsspiels betrachtet, wobei die Wahrscheinlichkeit, dass eine Seite gewinnt, durch das Feedback des Chemikers bestimmt wird. Dazu beantworten medizinische Chemiker in einer Webanwendung vorgegebene Fragen und wählen eines von zwei Molekülen aus. Insgesamt waren 35 medizinische Chemiker von Novartis an dem Prozess beteiligt, der zur Sammlung von mehr als 5.000 Anmerkungen führte.
Dieses Feedback führte zu einem impliziten Bewertungsmodell, das ein Modell mit zwei unabhängigen neuronalen Netzwerkstrukturen verwendet. Jeder Zweig hat ein festes Gewicht und die Moleküle werden mithilfe gemeinsamer Chemoinformatik-Deskriptoren charakterisiert. Während des Trainings werden die Parameter des Modells über einen binären Kreuzentropieverlust (BCE-Verlust) optimiert, der von der zugrunde liegenden Bewertungsdifferenz eines Molekülpaares und dem Feedback des Chemikers abhängt
Sobald das Training abgeschlossen ist, kann die Punktzahl für jedes beliebige Molekül abgeleitet werden, die dann für nachgelagerte Aufgaben in der Chemieinformatik verwendet werden kann.
Darüber hinaus kann das Modell die Ähnlichkeiten zwischen verschiedenen Medikamenten genauer bestimmen. Die in der Studie vorgeschlagene Lernbewertungsfunktion ist genauer als der herkömmliche Arzneimittelähnlichkeitsbewertungsindex (QED)Insbesondere
Um die Reproduzierbarkeit der Studie und die Weiterentwicklung des Fachgebiets zu fördern, stellen die Forscher auch ein Softwarepaket namens „MolSkill“ zur Verfügung, dasdas Modell und anonymisierte Antwortdaten enthält.
Probleme und Anwendungen des maschinellen Lernens im Bereich der medizinischen ChemieObwohl dieses Modell das von medizinischen Chemikern in ihrer Arbeit gesammelte Wissen reproduzieren kann, weist es auch einige Einschränkungen auf. Um die chemische Intuition zu erfassen, waren die bei der Datenerfassung gestellten Fragen zunächst immer vage. Auch wenn das vorgeschlagene Studiendesign im Vergleich zu früheren Studien zu einer größeren Übereinstimmung zwischen den Teilnehmern führte, ist die Methode des paarweisen Vergleichs nicht perfekt. Darüber hinaus führt der „Flatland-Irrtum“ dazu, dass Menschen dazu neigen, hochdimensionale Probleme in einen kleinen Satz von Variablen zu vereinfachen, die kognitiv verfolgt werden können, und diese Vereinfachung kann durch die persönlichen Eigenschaften jedes medizinischen Chemikers beeinflusst werden Das Forschungsteam gab jedoch an, dass das in dieser Studie vorgeschlagene Modell nicht auf den Anwendungsbereich der aktuellen Studie beschränkt ist. Insbesondere kann der besprochene Rahmen auf andere quantifizierbare, aber teure Observablen im Bereich der Arzneimittelentwicklung ausgeweitet werden. Darüber hinaus kann es Einblicke in noch unerforschte Bereiche des chemischen Raums geben. Vor diesem Hintergrund glaubt das Forschungsteam, dass eine ähnliche Architektur aufgebaut werden kann, indem man einige beliebte regelbasierte Filter aus künstlich generierten Trainingsdaten lernen lässt. Dieses Modell kann die große Einschränkung überwinden, die darin besteht, dass Verbindungen manuell gefiltert werden müssen, bevor Schlussfolgerungen gezogen werden können Der gleiche Ansatz kann auch zur Generierung von Verbindungsbewertungen verwendet werden, indem Kombinationen in Bibliotheken synthetischer Chemikalien priorisiert werden, bei denen das Screening aufgrund ihrer natürlichen Neuheit mit vorhandenen regelbasierten Methoden schwierig ist Eine weitere Sache, die noch einmal zum Ausdruck gebracht werden muss, ist: In einem prospektiven, primären Optimierungsszenario für ein bestimmtes Ziel müssen mehrere Informationsquellen (wie biologische Eigenschaften, ADMET usw.) umfassend berücksichtigt werden, um die Praktikabilität des Ziels zu testen Forschungsrahmen Das Forschungsteam schrieb in der Arbeit: „Maschinelle Lernmethoden können Tausende von Verbindungen entwerfen, und Technologien wie das Hochdurchsatz-Screening können eine große Anzahl von Kandidatenverbindungen in den frühen Phasen des Arzneimittelentwicklungsprozesses hervorheben.“ Die Bewertungsmethode schlug dies vor Es wird erwartet, dass diese Anwendung in den kommenden Jahren die Akzeptanz und das Vertrauen der Methode beschleunigen wird
Das obige ist der detaillierte Inhalt vonKI-Arzneimittelforscher tritt der Unterzeitschrift „Nature' bei: Nutzung von Fachwissen zur Beschleunigung der Arzneimittelentwicklung. Für weitere Informationen folgen Sie bitte anderen verwandten Artikeln auf der PHP chinesischen Website!
In Verbindung stehende Artikel
Mehr sehen- 1200-mal schneller! Das MIT entwickelt eine neue Generation der KI für die Arzneimittelforschung und -entwicklung, um das alte Modell zu überwinden
- Mithilfe von KI den „Schlüssel' zu Antikörpern erforschen und die Arzneimittelentwicklung beschleunigen – ein Interview mit dem Team von Baitu Biotechnology

